题目内容
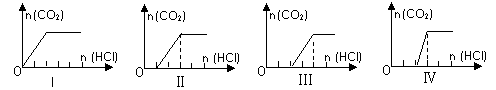
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是
| 溶液组成主要成分 | 对应图象 | 溶液中离子浓度关系 | |
| A | NaHCO3 | I | c(Na+) = c(HCO3-) |
| B | NaHCO3、Na2CO3 | Ⅱ | c(CO32-) < c(HCO3-) |
| C | NaOH、Na2CO3 | Ⅲ | c(OH-) > c(CO32-) |
| D | Na2CO3 | Ⅳ | c(Na+) = c(CO32-) + c(HCO3-) + c(H |
B
解析:
A、NaHCO3溶液中c(Na+) 与c(HCO3-)不等;
B、根据加入盐酸量的关系可看出NaHCO3与Na2CO3物质的量相等,根据CO32-、HCO3-电离和水解规律可得c(CO32-) < c(HCO3-);
C、根据图像可看出它与NaOH、Na2CO3这种组合是错误的,NaOH先与HCl反应,然后Na2CO3与HCl反应,但是生成的NaHCO3仅需要相同物质的量的HCl,所以图像不对应;
D、Na2CO3和图像显示的消耗HCl量不对应,故D错。

 科学实验活动册系列答案
科学实验活动册系列答案向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,可以得到不同的成分组合,其中混合组分的物质的量为1:1 请选择下列分析都正确的组合是:
|
| 溶液组成主要成分 | 溶液中离子浓度关系 |
| A | NaHCO3、Na2CO3 | c(CO32-) < c(HCO3-) |
| B | NaOH 、 Na2CO3 | c(OH-)<c(CO32-) |
| C | Na2CO3 | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D | NaHCO3、NaOH | c(Na+) = c(HCO3-) |
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,可以得到不同的成分组合,其中混合组分的物质的量为1:1 请选择下列分析都正确的组合是:
|
|
溶液组成主要成分 |
溶液中离子浓度关系 |
|
A |
NaHCO3、Na2CO3 |
c(CO32-) < c(HCO3-) |
|
B |
NaOH 、 Na2CO3 |
c(OH-)<c(CO32-) |
|
C |
Na2CO3 |
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
|
D |
NaHCO3、NaOH |
c(Na+) = c(HCO3-) |
(09上海奉贤区4月模拟)向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图:
![]()
![]()
![]()
![]() 则下列分析都正确的组合是:
则下列分析都正确的组合是:
| 溶液组成主要成分 | 对应图象 | 溶液中离子浓度关系 |
A | NaHCO3、Na2CO3 | Ⅱ | c(CO32-) < c(HCO3-) |
B | NaOH 、 Na2CO3 | Ⅲ | c(OH-)>c(CO32-) |
C | Na2CO3 | Ⅳ | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
D | NaHCO3 | I | c(Na+) = c(HCO3-) |
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,可以得到不同的成分组合,其中混合组分的物质的量为1:1 请选择下列分析都正确的组合是:
| 溶液组成主要成分 | 溶液中离子浓度关系 | |
| A | NaHCO3、Na2CO3 | c(CO32-) < c(HCO3-) |
| B | NaOH 、 Na2CO3 | c(OH-)<c(CO32-) |
| C | Na2CO3 | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D | NaHCO3、NaOH | c(Na+) = c(HCO3-) |