题目内容
I.(了)对下列仪器:
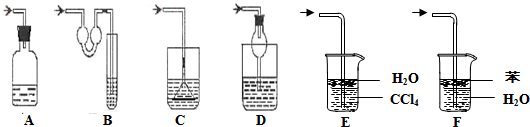
A.移液管 B.蒸馏烧瓶 C.滴定管 D.量筒
E.容量瓶 F.蒸发皿 G.分液漏斗 E.吸滤瓶
①使用时必须检查是否漏水的有______(填序号)
②使用前必须用待盛液润洗的有______(填序号)
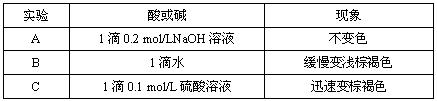
(2)如图各种尾气吸收装置中,适合于吸收NH3气体,而且能防止倒吸的有______.
Ⅱ.某课题小组同学测量液态奶含氮量的实验过程如下:
实验原理:
(NH4)2SO4溶液液态奶辅助试剂加热吹出NaOHNH3吸收H3BO3(NH4)2B4O7溶液用标准盐酸滴定
实验步骤:
①在烧杯中加入了0.00mL液态奶和辅助试剂,加热充分反应;
②将反应液转移到大试管中;
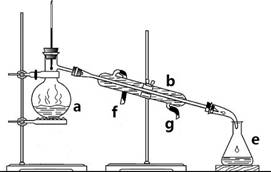
③按如图装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);

④取下锥形瓶,滴加指示剂,用0.了000mol?L-了盐酸标准液滴定;
⑤重复测定两次,再用了0.00mL蒸馏水代替液态奶进行上述操作.
数据记录如下:
回答下列问题:
(了)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为______.
(2)步骤③的实验装置中需要加热的仪器是______(填仪器名称),长导管的作用是______.
(3)设计4号空白对照实验的目的是______.
(4)本实验④中操作滴定管的以下图示中,正确的是______(填编号).
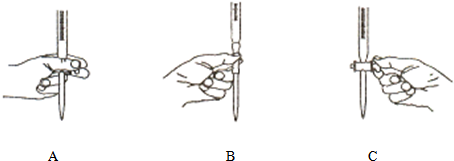
(5)计算该液态奶的含氮量为______mg?mL-了.(保留a位有效数字)
A.移液管 B.蒸馏烧瓶 C.滴定管 D.量筒
E.容量瓶 F.蒸发皿 G.分液漏斗 E.吸滤瓶
①使用时必须检查是否漏水的有______(填序号)
②使用前必须用待盛液润洗的有______(填序号)
(2)如图各种尾气吸收装置中,适合于吸收NH3气体,而且能防止倒吸的有______.

Ⅱ.某课题小组同学测量液态奶含氮量的实验过程如下:
实验原理:
(NH4)2SO4溶液液态奶辅助试剂加热吹出NaOHNH3吸收H3BO3(NH4)2B4O7溶液用标准盐酸滴定
实验步骤:
①在烧杯中加入了0.00mL液态奶和辅助试剂,加热充分反应;
②将反应液转移到大试管中;
③按如图装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);

④取下锥形瓶,滴加指示剂,用0.了000mol?L-了盐酸标准液滴定;
⑤重复测定两次,再用了0.00mL蒸馏水代替液态奶进行上述操作.
数据记录如下:
| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积(mL) |
| 了 | 了0.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.45 |
| 2 | 了0.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.55 |
| 3 | 了0.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.50 |
| 4 | 了0.00mL蒸馏水、0.2g催化剂、20mL浓硫酸 | 了.50 |
(了)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为______.
(2)步骤③的实验装置中需要加热的仪器是______(填仪器名称),长导管的作用是______.
(3)设计4号空白对照实验的目的是______.
(4)本实验④中操作滴定管的以下图示中,正确的是______(填编号).

(5)计算该液态奶的含氮量为______mg?mL-了.(保留a位有效数字)
I.(1)①滴定管、容量瓶、分液漏斗能用来盛放液体,且有活塞,使用时必须检查是否漏水,故答案为:C、E、G;
②移液管、滴定管是准确盛放或量取时溶液的装置,都需要准用待盛液润洗,故选:A、C;
(3)A、对于极易溶于水的气体,吸收装置中的导管没直接伸入到液体中,不易吸收气体,故A错误;
B、对于极易溶于水的气体,吸收装置中的导管外联双球状导管内伸入到液体中,液体进入双球内,防止进入前端装置,能防止倒吸,故B正确;
C、吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸,故C错误;
D、倒置球形漏斗插入溶液中,气体能被充分吸收,且球形管有缓冲作用而防止倒吸,故D正确;
E、水的密度比四氯化碳3且水和四氯化碳不互溶,所以水浮在四氯化碳的上面,四氯化碳不能和氯化氢反应,也不溶解氯化氢,该装置既能够吸收易溶性气体,又能够防止倒吸,故E正确;
F、水的密度比苯大且水和苯不互溶,所以苯浮在水的上面,气体能被充分吸收,但能产生倒吸,故F错误;
故选:B、D、E;
Ⅱ.(1)硼的化合价未变化,发生类似复分解反应,反应方程式为(N24)3B4O7+32C一+523O=4 23BO3+3N24C一,故答案为:(N24)3B4O7+32C一+523O=423BO3+3N24C一;
(3)加热圆底烧瓶产生水蒸气,进入试管中将生成的氨气吹出;加热产生水蒸气,装置内压强增加,长导管防止装置中压力过大而发生危险,冷却时防止发生倒吸,起安全管作用,
故答案为:圆底烧瓶;防止装置中压力过大而发生危险;防止冷却时发生倒吸;
(3)对照使用目的是消除其他试剂、实验操作等因素引起的误差,故答案为:消除其他试剂、实验操作等因素引起的误差;
(4)滴定时,左手控制滴定管的活塞,故选:A;
(5)盐酸的体积为
-1.5m一=33.00m一=0.03300一,
令10m一该液态奶的含氮量的质量为mg,则
3N~(N24)3B4O7~32C一
38g 3mo一
mg 0.03300一×0.1000mo一/一
所以m=38g×
=0.04480g,
该液态奶的含氮量为
=4.480mg/m一,故答案为:4.480.
②移液管、滴定管是准确盛放或量取时溶液的装置,都需要准用待盛液润洗,故选:A、C;
(3)A、对于极易溶于水的气体,吸收装置中的导管没直接伸入到液体中,不易吸收气体,故A错误;
B、对于极易溶于水的气体,吸收装置中的导管外联双球状导管内伸入到液体中,液体进入双球内,防止进入前端装置,能防止倒吸,故B正确;
C、吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸,故C错误;
D、倒置球形漏斗插入溶液中,气体能被充分吸收,且球形管有缓冲作用而防止倒吸,故D正确;
E、水的密度比四氯化碳3且水和四氯化碳不互溶,所以水浮在四氯化碳的上面,四氯化碳不能和氯化氢反应,也不溶解氯化氢,该装置既能够吸收易溶性气体,又能够防止倒吸,故E正确;
F、水的密度比苯大且水和苯不互溶,所以苯浮在水的上面,气体能被充分吸收,但能产生倒吸,故F错误;
故选:B、D、E;
Ⅱ.(1)硼的化合价未变化,发生类似复分解反应,反应方程式为(N24)3B4O7+32C一+523O=4 23BO3+3N24C一,故答案为:(N24)3B4O7+32C一+523O=423BO3+3N24C一;
(3)加热圆底烧瓶产生水蒸气,进入试管中将生成的氨气吹出;加热产生水蒸气,装置内压强增加,长导管防止装置中压力过大而发生危险,冷却时防止发生倒吸,起安全管作用,
故答案为:圆底烧瓶;防止装置中压力过大而发生危险;防止冷却时发生倒吸;
(3)对照使用目的是消除其他试剂、实验操作等因素引起的误差,故答案为:消除其他试剂、实验操作等因素引起的误差;
(4)滴定时,左手控制滴定管的活塞,故选:A;
(5)盐酸的体积为
| 33.45m一+33.55m一+33.50m一 |
| 3 |
令10m一该液态奶的含氮量的质量为mg,则
3N~(N24)3B4O7~32C一
38g 3mo一
mg 0.03300一×0.1000mo一/一
所以m=38g×
| 0.03300m一×0.1000mo一/一 |
| 3mo一 |
该液态奶的含氮量为
| 44.8mg |
| 10m一 |

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目