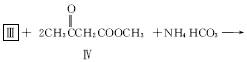题目内容
甲酸的下列性质中,可以证明它是弱电解质的是( )
A. 1 mol / L甲酸溶液的pH约为2
B. 甲酸能与水以任何比例互溶
C. 10 mL 1 mol / L甲酸恰好与10 mL 1 mol / L NaOH溶液完全反应
D. 在相同条件下,甲酸溶液的导电性比强酸溶液的弱
答案:AD
[解析] 若能说明在相同条件下甲酸只发生部分电离,便可以证明它是弱电解质。1 mol / L甲酸溶液的pH约为2,则c(H+)=0.01 mol / L,说明甲酸部分电离。在相同条件下,甲酸溶液中自由移动离子数较强酸少,其导电能力比强酸弱,即甲酸只发生部分电离。而B、C与甲酸的电离情况无关。

练习册系列答案
相关题目
 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
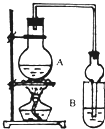
Ⅱ.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)A中浓硫酸的作用是
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是
(4)反应结束后D中的现象是
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰.
 ,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):

 代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为
代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为
 其合成原料2-呲啶甲酸的结构式为
其合成原料2-呲啶甲酸的结构式为