题目内容
将5.1g镁铝合金投入过量盐酸中充分反应,得到500mL溶液和5.6L标准状况下的H2。计算:
(1)合金中镁和铝的质量之比;
(2)所得溶液中Mg2+的物质的量浓度。
(1)合金中镁和铝的质量之比;
(2)所得溶液中Mg2+的物质的量浓度。
(1)8:9(2)0.2mol/L
试题分析:
解:(1)令镁、铝的物质的量分别为xmol、ymol,则:
Mg+2HCl=MgCl2+H2
x x
2Al+6HCl=2AlCl3+3H2
y 1.5y
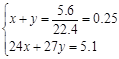
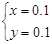
m(Mg):m(Al)=8:9
故m(Mg):m(Al)=24g/mol×0.1mol:27g/mol×0.1mol=8:9,
答:合金中镁和铝的质量之比为8:9
(2)n(Mg2+)=n(Mg)=0.1mol,故c(Mg2+)=
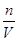 =
=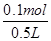 =0.2mol/L,
=0.2mol/L,答:所得溶液中Mg2+的物质的量浓度为0.2mol/L。

练习册系列答案
相关题目