题目内容
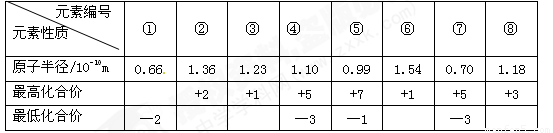
下表为短周期元素①~⑧的部分性质.
下列说法正确的是( )
 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A、元素④⑤形成的化合物是离子化合物 |
| B、元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强 |
| C、元素①⑧形成的化合物具有两性 |
| D、上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强 |
分析:由表中短周期元素①~⑧的部分性质可知,①只有-2价,则为O;④⑦均有+5、-3价,为第ⅤA族元素,结合原子半径可知,④为P,⑦为N;③⑥最高价都为+1,处于ⅠA,⑥的原子半径较大,且③的原子半径不是最小的,故③为Li、⑥为Na;②最高价为+2,原子半径大于Li,故②为Mg;⑤最高价为+7,最低价为-1,故⑤为Cl;⑧最高价为+3,原子半径大于大于P元素,故⑧为Al,然后结合元素及其单质、化合物的性质来解答.
解答:解:由表中短周期元素①~⑧的部分性质可知,①只有-2价,则为O;④⑦均有+5、-3价,为第ⅤA族元素,结合原子半径可知,④为P,⑦为N;③⑥最高价都为+1,处于ⅠA,⑥的原子半径较大,且③的原子半径不是最小的,故③为Li、⑥为Na;②最高价为+2,原子半径大于Li,故②为Mg;⑤最高价为+7,最低价为-1,故⑤为Cl;⑧最高价为+3,原子半径大于大于P元素,故⑧为Al,
A.元素④⑤形成的化合物PCl3、PCl5,均为共价化合物,故A错误;
B.非金属性N>P,则元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强,故B正确;
C.元素①⑧形成的化合物为Al2O3,与强酸、强碱反应,为两性氧化物,故C正确;
D.上表8种元素中,金属性最强的为⑥,所以元素⑥的最高价氧化物对应水化物的碱性最强,故D错误;
故选BC.
A.元素④⑤形成的化合物PCl3、PCl5,均为共价化合物,故A错误;
B.非金属性N>P,则元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强,故B正确;
C.元素①⑧形成的化合物为Al2O3,与强酸、强碱反应,为两性氧化物,故C正确;
D.上表8种元素中,金属性最强的为⑥,所以元素⑥的最高价氧化物对应水化物的碱性最强,故D错误;
故选BC.
点评:本题考查元素周期表和元素周期律,利用表中元素的性质来推断元素是解答本题的关键,并熟悉元素周期律来解答,题目难度中等.

练习册系列答案
相关题目
(2010?清远模拟)下表为短周期元素①~⑧的部分性质,下列说法正确的是( )
|
已知下表为短周期元素①~⑧的部分性质。
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径/10-10m |
0.73 |
1.30 |
1.34 |
1.06 |
0.99 |
1.54 |
0.75 |
1.18 |
|
最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
最低化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法正确的是( )
A.元素④⑤形成的化合物是离子化合物
B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性弱
C.元素①⑧形成的化合物具有两性
D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
下表为短周期元素①~⑧的部分性质。
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径/10-10m |
0.66 |
1.36 |
1.23 |
1.10 |
0.99 |
1.54 |
0.70 |
1.18 |
|
最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
最低化合价 |
—2 |
|
|
—3 |
—1 |
|
—3 |
|
下列说法正确的是 A.元素④⑤形成的化合物是离子化合物
B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性弱
C.元素①⑧形成的化合物具有两性
D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强