题目内容
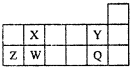 短周期元素X、Y、Z、W、Q在周期表中相对位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z、W、Q在周期表中相对位置如图所示.下列说法正确的是( )| A、工业上常用电解法生产Z、Q的单质 | B、形成的简单离子的半径大小顺序:r(Z)>r(Q)>r(Y) | C、Z的最高价氧化物对应水化物是三元弱酸 | D、最简单气态氢化物的热稳定性:W>X |
分析:根据元素在周期表中的位置可知,X为C元素,Y为F元素,Z为Al元素,W为Si元素,Q为Cl元素,据此解答.
解答:解:根据元素在周期表中的位置可知,X为C元素,Y为F元素,Z为Al元素,W为Si元素,Q为Cl元素,
A.工业上通常利用电解熔融的氧化铝生成Al,电解饱和的氯化钠溶液生成氯气,故A正确;
B.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径Cl->F->Al3+,故B错误;
C.Z的最高价氧化物对应水化物为氢氧化铝,属于两性氢氧化物,若为酸,属于一元酸,故C错误;
D.非金属性X>W,故氢化物热稳定性:X>W,故D错误;
故选A.
A.工业上通常利用电解熔融的氧化铝生成Al,电解饱和的氯化钠溶液生成氯气,故A正确;
B.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径Cl->F->Al3+,故B错误;
C.Z的最高价氧化物对应水化物为氢氧化铝,属于两性氢氧化物,若为酸,属于一元酸,故C错误;
D.非金属性X>W,故氢化物热稳定性:X>W,故D错误;
故选A.
点评:本题考查位置结构性质关系及应用,题目难度中等,注意掌握元素周期表的结构和元素周期律的递变规律.

练习册系列答案
相关题目
碱金属元素可形成离子型氢化物,下表是同一短周期元素X、Y、Z三种元素氢化物的某些性质
则这三种元素的原子序数从大到小的排列顺序为( )
| 元素 | 熔点(℃) | 沸点(℃) | 与水作用 | 纯液体的导电性 |
| X | -183 | -162 | 不与水反应也不溶于水 | 不导电 |
| Y | -102 | 19 | 放热,形成的酸是弱酸 | 不导电 |
| Z | 680 | - | 剧烈反应生成H2,溶液呈碱性 | 导电 |
| A、X、Y、Z |
| B、Z、X、Y |
| C、Y、X、Z |
| D、Z、Y、X |
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法中不正确的是( )
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |
 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )