题目内容
A、B、C、D四种化合物均为中学课本中常见的物质,它们的化学式都符合RX2型,且其中所含元素的原子结构均达8电子结构。组成这四种化合物中的元素的原子序数都不超过20.构成这四种化合物的化学键为:C只有离子键,D既有离子键又有非极性共价键。A,B只有共价键,A的熔点很低,B的熔点却很高。A和C都难与各种氢卤酸反应;B、C都难溶于水。D却与水剧烈反应,所产生的气体是一种烃。A能在空气里燃烧,B、C、D则不能。B可与某种氢卤酸反应,所产生的气体不能燃烧。根据上述进行判断:⑴ 写出四种化合物的化学式:
A. ; B. ; C. ; D. 。
⑵ 写出有关化学反应方程式:
a. A在空气中燃烧: ,
b. B与氢卤酸反应: ,
c. D与水反应: 。
答案:
解析:
提示:
解析:
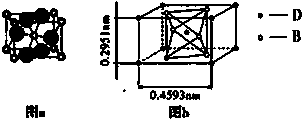
| ① A:CS2 B:SiO2 C:CaF2 D:CaC2
② a: b: c:
|
提示:
| D既有离子键又有非极性共价键的化合物教材中只有两个,Na2O2和CaF2,显然前者不符合RX2型,对照后面性质,D能与水剧烈反应产生气态烃,确定D为CaC2。其次,C只有离子键,但却难溶于水。前20号元素组成的RX2型化合物中只有CaF2符合。A、B为共价化合物且B的熔点很高,难溶于水,定为原子晶体,只有SiO2,它可于HF反应生成SiF4↑(该气体不能燃烧),最后确定A,它的熔点低,应为分子晶体,易燃烧多为有机物,定为CS2
|

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.
(2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.