题目内容
某有机物完全燃烧时只生成二氧化碳与水,取2.3g 该有机物完全燃烧,将产物通过浓硫酸,浓硫酸增重2.7g,继续将产物通过碱石灰,碱石灰增重4.4克,已知该有机物相对分子质量为46.
(1)求该有机物的分子式;
(2)写出该有机物可能的同分异构体的结构简式.
(1)求该有机物的分子式;
(2)写出该有机物可能的同分异构体的结构简式.
分析:由一定质量有机物燃烧产物可计算有机物的实验式,再根据相对分子质量可计算并写出分子式,然后写出同分异构体.
解答:解:(1)使浓硫酸增重可知水的质量为2.7g,可计算出n(H2O)=
=0.15 mol,n(H)=0.3 mol,m(H)=0.3g;使碱石灰增重4.4g,可知二氧化碳质量为4.4g,n(C)=n(CO2)=
=0.1 mol,m(C)=1.2g,m(C)+m(H)=1.5g,因有机物的质量为2.3g,所以有机物中氧的质量为0.8g,n(O)=
=0.05mol,
n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,即实验式为C2H6O,设分子式为(C2H6O)n,又A的相对分子质量为46,解得:n=1,
答:有机物的分子式为:C2H6O;
(2)C2H6O的同分异构体的结构简式为: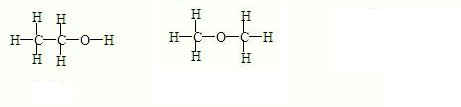 ;
;
答:该有机物可能的同分异构体的结构简式为 .
.
| 2.7g |
| 18 g/mol |
| 4.4g |
| 44g/mol |
| 0.8g |
| 16g/mol |
n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,即实验式为C2H6O,设分子式为(C2H6O)n,又A的相对分子质量为46,解得:n=1,
答:有机物的分子式为:C2H6O;
(2)C2H6O的同分异构体的结构简式为:
 ;
;答:该有机物可能的同分异构体的结构简式为
 .
.点评:此题考查了分子式的计算和同分异构体的书写,计算时含氧可根据质量守恒来确定和计算.

练习册系列答案
相关题目