题目内容
2.X、Y、Z、W是四种短周期元素,X-和Y+具有相同的电子层结构,Z的一种核素在考古时常用来鉴定一些文物的年代,W可形成两种常见的液态氢化物.下列说法正确的是( )| A. | Y在空气中燃烧一定生成Y2O2 | B. | Z只能形成两种含氧酸根 | ||
| C. | X-半径一定比Y+半径大 | D. | W 的氢化物一定比Z的氢化物稳定 |
分析 X、Y、Z、W是四种短周期元素,Z的一种核素在考古时常用来鉴定一些文物的年代,用的是C14,则Z为C元素;W可形成两种常见的液态氢化物,则W为O元素;X-和Y+具有相同的电子层结构,则X为F元素,Y为Na元素,结合元素周期律的递变规律解答该题.
解答 解:X、Y、Z、W是四种短周期元素,Z的一种核素在考古时常用来鉴定一些文物的年代,用的是C14,则Z为C元素;W可形成两种常见的液态氢化物,则W为O元素;X-和Y+具有相同的电子层结构,则X为F元素,Y为Na元素,
A.Na在空气中燃烧生成Na2O2,故A正确;
B.C元素形成的含氧酸有多种,如碳酸、甲酸乙酸、丙酸等,故B错误;
C.电子排布相同的离子,原子序数越大,半径越小,X得电子后与Y失电子后电子数相同,则Y的原子序数大于X,所以X-半径一定比Y+半径大,故C正确;
D.W为O元素,Z为C元素,O的氢化物不一定比C的氢化物稳定,如过氧化氢的稳定性小于甲烷,故D错误.
故选AC.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,本题注意正确推断元素的种类为解答该题的关键,易错点为C,注意碳氢化合物的种类以及性质.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
13.下列说法不正确的是( )
| A. | 向沸水中滴加饱和氯化铁溶液,可以制备氢氧化铁胶体,有净水的功能 | |
| B. | 容量瓶、滴定管使用前均需要检漏,并需要润洗以减小实验误差 | |
| C. | 甲烷中混有的少量乙烯可以通过溴水洗涤净化 | |
| D. | 分离乙酸乙酯和乙酸混合液时,先加入一定量的氢氧化钠溶液,生成乙酸钠后进行蒸馏,然后在乙酸钠溶液中加入足量的硫酸再蒸馏可得乙酸 |
17. 往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )
往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )
 往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )
往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )| A. | 温度T,逆反应速率υ逆 | B. | 温度T,气体的密度ρ | ||
| C. | 压强P,平衡常数K | D. | 压强P,N2O4转化率α |
7.如图所示是四种常见有机物的比例模型示意图.下列说法正确的是( )
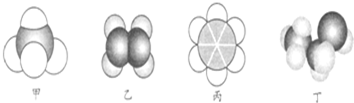

| A. | 22.4 L甲中含有10 mol电子 | |
| B. | 乙与乙的加聚产物都能使溴水褪色 | |
| C. | 丙不能与溴水、酸性高锰酸钾溶液发生反应 | |
| D. | 丙、丁都可以萃取溴水中的溴单质 |
14.下列各组X与Y原子所形成的极性共价键X-Y中,极性最强的是( )
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p5 | D. | X:2s22p3 Y:1s1 |
11.实验是研究化学的基础,下列有关实验的方法、装置或操作都正确的是( )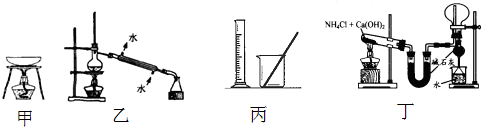

| A. | 从KI和I2的固体混合物中回收I2,可使用如图甲所示实验装置 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 用图丙所示仪器配制0.150mol/LNaOH溶液 | |
| D. | 如图丁所示可用于实验室制氨气并收集干燥的氨气 |

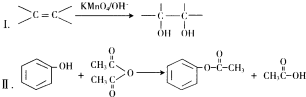
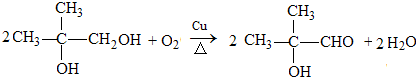 .
.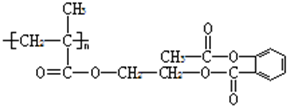 .
.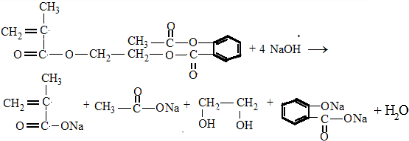 .
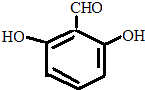
.
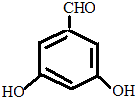
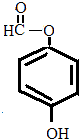 .
.