题目内容
(08上海松江区模拟)过碳酸钠是由碳酸钠和过氧化氢复合形成的一种新型氧系漂白剂,具有碳酸钠和过氧化氢的双重性质,其分子式为2Na2CO3?3H2O2,已知过渡元素的金属离子可作为催化剂使之分解。
它的制备原理和湿法生产路线如下:2Na2CO3 + 3H2O2 → 2 Na2CO3?3H2O2
 |
回答下列问题:
(1)反应控制在0~5℃条件下进行,其主要原因是 ,流程中的“分离”指的是实验操作中的 ;
(2)工业碳酸钠中一般含有少量锰、铜等金属离子(用M2+表示),加入稳定剂的作用是将M2+沉淀而除去,M2+对产品的不良影响是 ,
若加入的稳定剂是Na2SiO3,反应的离子方程式为 ;
(3)加入的食盐为盐析剂,其原理是降低过碳酸钠的溶解度使之析出。盐析是物理变化还是化学变化? ;
(4)过碳酸钠在生产上的应用是利用它分解所释放的H2O2。以铜为原料用H2O2氧化是工业上制胆矾的方法之一。做法是:
将铜丝放到一定量的稀硫酸中,控温在50℃,加入一定量的H2O2溶液,反应0.5h后,升温到60℃,再持续反应1 h,过滤后取滤液,再经过“某些操作”、减压抽滤,用少量95%的酒精淋洗后晾干,可得CuSO4?5H2O。
①在反应中,起氧化作用的是H2O2,写出H2O2在稀硫酸中氧化单质铜的化学反应方程式 ;
②处理滤液时的“某些操作”指的是 ;
③晶体采用酒精淋洗的优点是 。
答案:(1)防止H2O2和过碳酸钠因温度较高而分解 (1分) 过滤(1分)
(2)会催化过碳酸钠的分解 (1分) M2+ + SiO32- → MSiO3↓(2分)
(3)物理变化(1分)
(4)Cu + H2O2 + H2SO4 → CuSO4 + 2H2O (2分) 蒸发浓缩,冷却结晶(2分)
酒精与水互溶且极易挥发,并且也减少晶体的溶解(2分)

2(08浙江省开化中学模拟)实验室中根据2SO2+O2![]() 2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
 |
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是 。装置D的三个作用是 ①
② ③
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
(6)装置F中U型管内收集到的物质的颜色、状态是
(7)装置G的作用是
(8)从G装置导出的尾气处理方法是
(08皖南8校第三次联考)1 L某混合溶液,可能含有的离子如下表:
可能大量还有的阳离子 |
|
可能大量还有的阴离子 |
|
 (1)往该溶液中逐滴加入
(1)往该溶液中逐滴加入![]() 溶液并适当
溶液并适当
加热,产生沉淀和气体的物质的量(![]() )
)
与加入![]() 溶液的体积(V)的关系
溶液的体积(V)的关系
如右图所示。则该溶液中确定含有的离子
有_______________;不能确定是否含有
的阳离子有______________,要确定其存
在可补充做的实验是___________;肯定不存在的阴离子有_________________。
(2)经检测,该溶液中含有大量的![]() ,若向1 L该混合溶液中通入―定晕的
,若向1 L该混合溶液中通入―定晕的![]() ,溶液中
,溶液中![]() 的物质的量与通入
的物质的量与通入![]() 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:

 (08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()
(08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()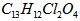
 溶液发生显色反应
溶液发生显色反应 。下列说法正确的是()
。下列说法正确的是() A.a极为电池的正极
A.a极为电池的正极
 厍仑的电量
厍仑的电量  ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol