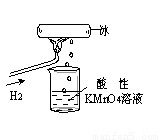
题目内容
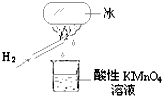 如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,溶液呈血红色.判断下列说法中不正确的是( )
如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,溶液呈血红色.判断下列说法中不正确的是( )分析:氢气在空气中燃烧,产物遇冰块冷凝滴入烧杯中.据紫色的KMnO4溶液具有强氧化性,若使其褪色,必定有还原性物质滴入杯中;使FeCl2、KSCN混合溶液变红,必定有氧化性物质将Fe2+氧化.从而确定这一冷凝产物既有氧化性又有还原性,根据氧元素的化合价可知该物质可能是HO2、H2O2.
解答:解:A、烧杯中酸性KMnO4溶液褪色,说明H2燃烧的产物中可能有还原性物质.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液呈血红色,说明有Fe3+生成,进而说明H2燃烧的产物中可能有氧化性物质,由此说明H2燃烧的产物有还原性和氧化性,故A正确;
B、根据氧元素的化合价可知HO2、H2O2具有氧化性与还原性,遇强氧化剂是表现还原性,遇较强的还原剂是表现氧化性,故B正确;
C、KI淀粉溶液中的KI具有还原性,能验证生成物具有氧化性,故C错误;
D、H2O2、HO2与KMnO4物反应产物都是H2O,1molH2O2转化为H2O转移2mol电子;1molHO2转化为H2O转移1mol电子,所以相同物质的量的H2O2、HO2转移的电子的物质的量为2:1,所以相同物质的量的H2O2、HO2消耗KMnO4物质的量为2:1,故D正确;
故选:C.
B、根据氧元素的化合价可知HO2、H2O2具有氧化性与还原性,遇强氧化剂是表现还原性,遇较强的还原剂是表现氧化性,故B正确;
C、KI淀粉溶液中的KI具有还原性,能验证生成物具有氧化性,故C错误;
D、H2O2、HO2与KMnO4物反应产物都是H2O,1molH2O2转化为H2O转移2mol电子;1molHO2转化为H2O转移1mol电子,所以相同物质的量的H2O2、HO2转移的电子的物质的量为2:1,所以相同物质的量的H2O2、HO2消耗KMnO4物质的量为2:1,故D正确;
故选:C.
点评:本题考查化学实验现象的分析、物质的性质知识、氧化性与还原性等,难度不大,根据现象推断物质具有的性质是关键.

练习册系列答案
相关题目
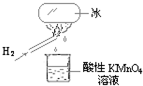 陈老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,溶液呈血红色.判断下列说法中正确的是( )
陈老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,溶液呈血红色.判断下列说法中正确的是( )