题目内容
20.A、B、C、D、代表4种元素,请完成下列问题(1)A元素的负一价离子的电子层结构与氩相同,B元素的正一价离子的电子层结构与氙相同,A、B形成的化合物的化学式为CsCl.
(2)C元素的正三价离子的3d轨道为半充满状态,C元素的符号为Fe.在同期表中位置第四周期,第ⅤⅢ族,其基态原子的价电子排布图为3d64s2.
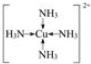
(3)D元素基态原子的M层全充满,N层没有成对电子,只有1个未成对电子,其硫酸盐逐滴加入氨水生成难溶物的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,继续添加氨水,难溶物溶解,得到深蓝色溶液的离子方程为Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH-,写出阳离子的结构式
 .
.
分析 (1)根据离子的电子排布知识来确定元素,根据氯化铯晶体结构决定的性质来回答;
(2)根据元素基态原子的核外电子排布知识来回答;
(3)D元素基态原子的M层全充满,N层没有成对电子,只有1个未成对电子,则该元素的价电子排布式为3d104s1,即为铜,铜离子与氨水反应生成氢氧化铜蓝色沉淀,氨水过量,与氢氧化铜反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液,据此分析解答.
解答 解:(1)A元素的负一价离子的电子层结构与氩相同,所以为Cl-,B元素的正一价离子的电子层结构与氙相同,所以为Cs+,形成的化合物的化学式为CsCl,故答案为:CsCl;
(2)C元素的正三价离子的3d轨道为半充满,其基态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,为Fe,其基态原子的价电子排布图为3d64s2,在同期表中位置为第四周期,第ⅤⅢ族,故答案为:Fe;第四周期,第ⅤⅢ族;3d64s2;
(3)D元素基态原子的M层全充满,N层没有成对电子,只有1个未成对电子,则该元素的价电子排布式为3d104s1,即为铜,则铜离子与氨水反应生成氢氧化铜蓝色沉淀,氨水过量,与氢氧化铜反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH-,其中[Cu(NH3)4]2+的结构为以铜离子为中心离子4个氨气作为配体形成的配合物离子,即 ;
;
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH-; .
.
点评 本题考查元素推断题以及配合物离子的形成过程,题目难度中等,推断元素的种类为该题的关键,注意相关知识的积累,把握原子结构的相关规律.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①C2H2 与CH3CHO
②C2H2与C6H6
③C7H8与C6H12
④HCOOCH3与CH3COOH.
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ②④ |
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml)[来 | 5 | 11 | 7 | 8[ | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是MnO2(粉末状)>FeCl3>KI>活性炭,等质量的固体催化剂,颗粒大小对催化效率有什么影响颗粒越小催化效果越好.
(3)实验发现新鲜的动物肝脏对H2O2 的分解也有显著的催化作用,但当往溶液中加入盐酸,或给溶液加热时,就会失去催化能力,合理的解释是催化剂失去活性.
| A. | 溴苯和水 | B. | 丙醇和乙二醇 | C. | 碘和乙醇 | D. | 甘油和水 |
| A. | 元素原子半径大小呈周期性变化 | |
| B. | 元素原子量依次递增 | |
| C. | 元素的最高正化合价呈周期性变化 | |
| D. | 元素原子最外层电子排布呈周期性变化 |
| A. | 盐酸、空气、醋酸、干冰 | B. | 冰醋酸、碱石灰、硫酸钠、乙醇 | ||
| C. | 蛋白质、油脂、苛性钠、石灰石 | D. | 胆矾、漂白粉、氯化钾、硫酸钡 |
 ;
;