题目内容
已知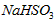 溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的
溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的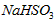 溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度的关系中(R表示S或C),一定正确的是
溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度的关系中(R表示S或C),一定正确的是
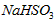 溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的
溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的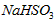 溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度的关系中(R表示S或C),一定正确的是
溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度的关系中(R表示S或C),一定正确的是[ ]
A.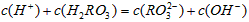
B.
C.
D.两溶液中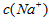 .
.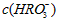 .
.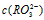 分别相等
分别相等
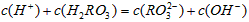
B.

C.

D.两溶液中
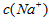 .
.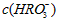 .
.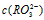 分别相等
分别相等 A

练习册系列答案
相关题目