题目内容
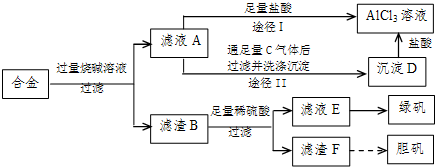
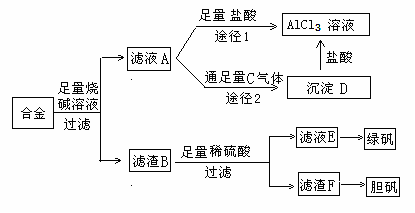
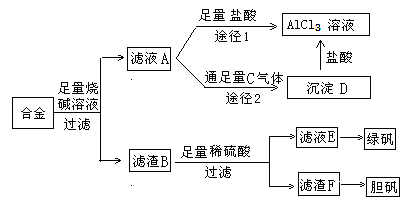
某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4?7H2O)和胆矾晶体(CuSO4?5H2O),以探索工业废料的再利用。其实验方案如下图:
![]()

试回答下列问题:
![]() (1)写出滤液A转化为沉淀D的离子方程式_________________________________。
(1)写出滤液A转化为沉淀D的离子方程式_________________________________。
![]() (2)由滤液A制AlCl3溶液的途径有I和II两条,你认为合理的是途径_________(填“I”或“II”),理由是
(2)由滤液A制AlCl3溶液的途径有I和II两条,你认为合理的是途径_________(填“I”或“II”),理由是
(3)从滤液E中得到绿矾晶体的实验操作是(不考虑E中的溶质被氧化这一因素):
_____________________________________________________________________。
(4)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总的化学方程式为_________________________________。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否合理?___________ 。理由是 。
(1)![]()
(2)Ⅱ因为滤液A是偏铝酸钠和氢氧化钠溶液,按途径I直接向A中加入盐酸得到的AlCl3溶液中含有大量的氯化钠杂质;按途径Ⅱ通入二氧化碳气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液。所以途径Ⅱ合理。
(3)蒸发浓缩、冷却结晶
(4)![]() 或
或![]()
(5)不合理 因为该方案操作步骤多、时间长,消耗试剂量大
(除(4)、(5)中第一个空每空1分以外,其余每空2分)