题目内容
为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl
下列说法错误的是
| A.负极反应式: Ag+Cl――e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Cl―不断向电池的正极移动 |
| D.Na2Mn5O10是还原产物 |
C
解析试题分析:A、银化合价升高失去电子,为负极生成AgCl,正确;B、从反应物银计算转移电子数,正确;C、原电池中阴离子向负极移动,错误;D、锰化合价降低,是还原产物,正确。
考点:考查氧化还原反应有关问题。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中错误的是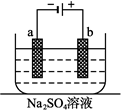
| A.a电极附近呈红色,b电极附近呈蓝色 |
| B.a电极附近呈蓝色,b电极附近呈红色 |
| C.逸出气体的体积,a电极的大于b电极的 |
| D.a、b两电极都逸出无色无味气体 |
臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如下图所示,下列有关说法不正确的是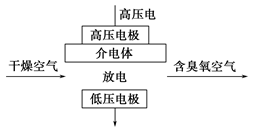
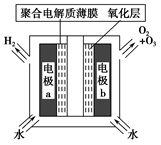
A.高压放电法,反应的原理为3O2 2O3 2O3 |
| B.高压放电出来的空气中,除含臭氧外还含有氮的氧化物 |
| C.电解时,电极b周围发生的电极反应有3H2O-6e-=O3↑+6H+和2H2O-4e-=O2↑+4H+ |
| D.电解时,H+由电极a经聚合固体电解质膜流向电极b |
全世界短年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是
| A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池 |
| B.金属棒X的材料应该是比镁活泼的金属 |
| C.金属棒X上发生反应:M一ne一——Mn+ |
| D.这种方法称为牺牲阳极的阴极保护法 |
有关右图装置中的叙述正确的是 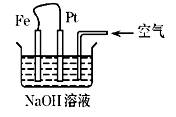
| A.这是电解NaOH溶液的装置 |
| B.这是一个原电池装置 |
| C.Pt为负极,其电极反应为:O2+2H2O+4e-= 4OH- |
| D.Fe为阳极,其电极反应为:Fe-2e-+2OH- = 2Fe(OH)2 |
利用如图所示装置可以模拟铁的电化学防护。下列说法不正确的是 ( )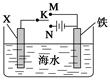
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于M处,铁极发生氧化反应 |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀 |
| D.若X为碳棒,开关K置于N处,X极发生氧化反应 |
下列关于金属腐蚀与防护的说法错误的是
| A.当镀锡铁制品的镀层破损时,镀层不再对铁制品起保护作用 |
| B.在空气与水面交接处的钢柱,比在水下部分的钢柱容易腐蚀 |
| C.钢铁不论发生析氢腐蚀还时吸氧腐蚀,其负极反应都为Fe-2e-=Fe2+ |
| D.将输油管道与电源的正极相连的防护方法叫做牺牲阳极的阴极保护法 |
银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是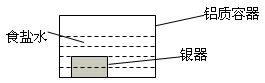
| A.该处理过程中电能转化为化学能 |
| B.银器为正极,Ag2S还原为单质银 |
| C.Ag2S溶解于食盐水生成了AgCl |
| D.铝质容器为阳极,其质量变轻 |
如图装置中,U形管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )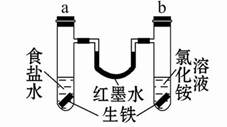
| A.a中发生了吸氧腐蚀,b中发生了析氢腐蚀 |
| B.两试管中负极反应均是:Fe-2e-=Fe2+ |
| C.生铁块中碳作原电池正极 |
| D.在一段时间后,红墨水两边液面变为左低右高 |