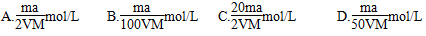题目内容
标准状况下H2和Cl2组成的混合气体amol,其中氯气的体积分数为w。经光照后缓缓通入含bmolNaOH的溶液中充分反应,测得最终溶液中含有c molNaClO(c>0),则下列说法正确的是
A.若c>b - a,则 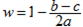 |
B.若a + c>b,则 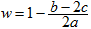 |
| C.若b="a" + c,则 w=0.5 |
D.若a<b-c,则  |
B、D
试题分析:可能发生的反应为:① H2+Cl2
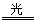 2HCl;②HCl+NaOH=NaCl+H2O;③ Cl2+2NaOH ="NaCl+" NaClO+H2O。混合气体中氯气的物质的量为awmol。因为最终溶液中含有c molNaClO(c>0)说明Cl2对于H2来说是过量的。则根据③可知消耗Cl2的物质的量为cmol;消耗NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为(aW-c)mol,H2的物质的量为(a-aW)mol。产生的HCl的物质的量为2(aW-c)mol.其消耗的NaOH的物质的量为2(aW-c)mol。若恰好完全反应。则b="2c+2(aW-c)" , (aw-c)mol=(a-aW)mol。2aw=a+c.钠元素的存在形式NaCl、NaClO。b= 2aw。即恰好完全反应时b=a+c。当a+c >b, 即c>b – a时,对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH不足量,n(NaClO)=cmol,消耗的NaOH的物质的量为2cmol,反应②消耗的NaOH的物质的量为(b-2c)mol。HCl的物质的量为(b-2c)mol,由于①反应Cl2过量,所以n(H2)= (b-2c)/2mol.。n(Cl2)=" a-(b-2c)/2mol" ="(2a-b+2c)" /2mol.所以氯气的体积分数w= n(Cl2)÷n(总)= (2a-b+2c)/2mol÷amol=
2HCl;②HCl+NaOH=NaCl+H2O;③ Cl2+2NaOH ="NaCl+" NaClO+H2O。混合气体中氯气的物质的量为awmol。因为最终溶液中含有c molNaClO(c>0)说明Cl2对于H2来说是过量的。则根据③可知消耗Cl2的物质的量为cmol;消耗NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为(aW-c)mol,H2的物质的量为(a-aW)mol。产生的HCl的物质的量为2(aW-c)mol.其消耗的NaOH的物质的量为2(aW-c)mol。若恰好完全反应。则b="2c+2(aW-c)" , (aw-c)mol=(a-aW)mol。2aw=a+c.钠元素的存在形式NaCl、NaClO。b= 2aw。即恰好完全反应时b=a+c。当a+c >b, 即c>b – a时,对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH不足量,n(NaClO)=cmol,消耗的NaOH的物质的量为2cmol,反应②消耗的NaOH的物质的量为(b-2c)mol。HCl的物质的量为(b-2c)mol,由于①反应Cl2过量,所以n(H2)= (b-2c)/2mol.。n(Cl2)=" a-(b-2c)/2mol" ="(2a-b+2c)" /2mol.所以氯气的体积分数w= n(Cl2)÷n(总)= (2a-b+2c)/2mol÷amol=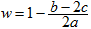 .因此A错误;B正确。C.若b="a" + c,H2和Cl2不仅发生①反应,还发生③反应都则 w>0.5。错误。D. 若a+c<b,即a<b-c则对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH过量,n(NaClO)="cmol" ,该反应消耗的NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为 (aw-c)mol, H2的物质的量为(a-aw)mol. (aw-c) =(a-aW),2aw=a+c,
.因此A错误;B正确。C.若b="a" + c,H2和Cl2不仅发生①反应,还发生③反应都则 w>0.5。错误。D. 若a+c<b,即a<b-c则对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH过量,n(NaClO)="cmol" ,该反应消耗的NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为 (aw-c)mol, H2的物质的量为(a-aw)mol. (aw-c) =(a-aW),2aw=a+c, 。正确。2和Cl2的混合气体光照后被NaOH溶液吸收时各种物质的相对量的多少的知识。
。正确。2和Cl2的混合气体光照后被NaOH溶液吸收时各种物质的相对量的多少的知识。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目