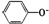
题目内容
已知苯酚钠溶液中通入二氧化碳,充分反应后只能生成苯酚和碳酸氢钠;而偏铝酸钠溶液中通入二氧化碳时,可生成氢氧化铝和碳酸钠,则下列说法正确的是( )
分析:A、酸性:氢氧化铝<苯酚<碳酸;
B、结合氢离子的能力看其酸性越弱(碱性越强)越容易结合氢离子;
C、在该些溶液中,阴离子酸性:HCO3->C6H5O->CO32->AlO2-,酸性越强碱性越弱,即:偏铝酸钠>碳酸钠>苯酚钠>碳酸氢钠;
D、碱性越强PH越大,相同pH的下列溶液其物质的量浓度:偏铝酸钠<碳酸钠<苯酚钠<碳酸氢钠;
B、结合氢离子的能力看其酸性越弱(碱性越强)越容易结合氢离子;
C、在该些溶液中,阴离子酸性:HCO3->C6H5O->CO32->AlO2-,酸性越强碱性越弱,即:偏铝酸钠>碳酸钠>苯酚钠>碳酸氢钠;
D、碱性越强PH越大,相同pH的下列溶液其物质的量浓度:偏铝酸钠<碳酸钠<苯酚钠<碳酸氢钠;
解答:A.酸性:依据二氧化碳和苯酚钠反应生成苯酚,苯酚和偏铝酸钠反应生成氢氧化铝,溶液酸性为:氢氧化铝<苯酚<碳酸;故A错误;
B、结合氢离子的能力看其酸性越弱(碱性越强)越容易结合氢离子,结合质子的能力: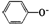 <HCO3-<CO32-<AlO2,故B错误;
<HCO3-<CO32-<AlO2,故B错误;
C、在该些溶液中,阴离子酸性::HCO3->C6H5O->CO32->AlO2-,酸性越强碱性越弱,即:偏铝酸钠>碳酸钠>苯酚钠>碳酸氢钠,故C正确;
D、碱性越强PH越大,相同pH的下列溶液其物质的量浓度,越易水解的浓度越小,得到浓度关系为:偏铝酸钠<碳酸钠<苯酚钠<碳酸氢钠;故D错误;
故选C.
B、结合氢离子的能力看其酸性越弱(碱性越强)越容易结合氢离子,结合质子的能力:
 <HCO3-<CO32-<AlO2,故B错误;
<HCO3-<CO32-<AlO2,故B错误;C、在该些溶液中,阴离子酸性::HCO3->C6H5O->CO32->AlO2-,酸性越强碱性越弱,即:偏铝酸钠>碳酸钠>苯酚钠>碳酸氢钠,故C正确;
D、碱性越强PH越大,相同pH的下列溶液其物质的量浓度,越易水解的浓度越小,得到浓度关系为:偏铝酸钠<碳酸钠<苯酚钠<碳酸氢钠;故D错误;
故选C.
点评:本题考查了弱酸强弱的比较分析,对应盐水解的 溶液酸碱性判断,掌握常见弱酸的强弱是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
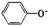 <HCO3-<CO32-<AlO2-
<HCO3-<CO32-<AlO2-