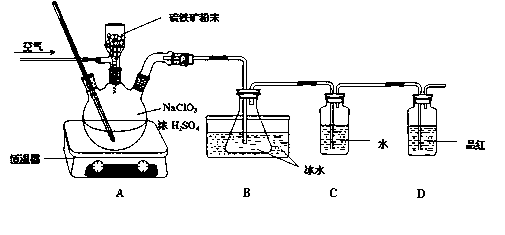
题目内容
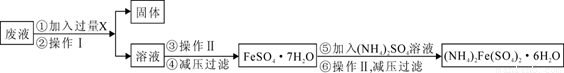
亚铁盐在空气中易被氧化,但是形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O 商品名莫尔盐]是一种重要的化学试剂,实验室用废铁片制取硫酸亚铁铵的流程如下方案一所示: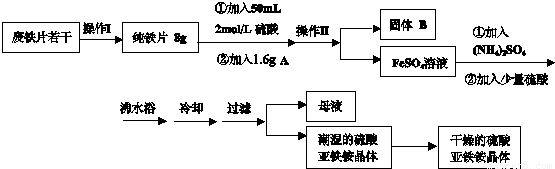
请回答下列问题:
(1)操作Ⅰ主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂______(填序号)
a.H2O b.3mol?L-1 H2SO4 c.热的10%的Na2CO3溶液
(2)若A物质为CuSO4,其加入的目的是______,则固体B的成分为______.
(3)操作Ⅱ的名称是______,所用主要玻璃仪器有:烧杯、______.
(4)加入少量硫酸可以调节pH为1~2,其作用是______(结合化学用语和简要语言说明).
(5)选用下列提供的试剂,设计实验验证硫酸亚铁铵晶体中含有Fe2+离子,而不含Fe3+.
提供的试剂:稀硫酸,KSCN溶液,新配制的氯水,NaOH溶液.
检验方法:______.
(6)在此流程中,理论上得到硫酸亚铁铵晶体______g(精确到小数点后两位).
相关物质的摩尔质量如下,单位g/mol,(NH4)2SO4:132; FeSO4:152; H2O:18
(7)该流程图中的CuSO4可以发生多种化学反应,如果在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.则生成CuCl的离子方程式是______ 2CuCl↓+SO42-+2H+
(2)A物质为CuSO4,加入后和铁发生反应生成铜析出,和铁在硫酸溶液中形成原电池反应加快反应进行,过滤得到固体为铁和铜;
(3)操作Ⅱ是分离固体和液体利用过滤操作进行分离,过滤装置需要的玻璃仪器是漏斗、玻璃棒、烧杯;
(4)加入少量硫酸可以调节pH为1~2是抑制亚铁离子和铵根离子水解,得到更多的产品;
(5)依据亚铁离子和铁离子的检验方法设计实验验证,
(6)铁和硫酸反应生成亚铁离子物质的量与铁与硫酸铜反应生成的亚铁离子物质的量之和为生成硫酸亚铁铵中 铁元素的物质的量守恒计算得到;
(7)如果在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀判断发生了氧化还原反应,亚硫酸根离子被铜离子氧化为硫酸根离子;
解答:解:(1)碳酸钠溶液水解显碱性,油污在碳酸钠溶液中水解生成溶于水的物质除去,水和硫酸不能除去油污,操作Ⅰ主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂是碳酸钠溶液
故答案为:c;
(2)若A物质为CuSO4,加入后和铁发生反应生成铜析出,和铁在硫酸溶液中形成原电池反应加快反应进行,过滤得到固体为铁和铜;
故答案为:形成微小原电池,加快铁与硫酸反应速率;
(3)操作Ⅱ是分离固体和液体利用过滤操作进行分离,过滤装置需要的玻璃仪器是漏斗、玻璃棒、烧杯;
故答案为:过滤;漏斗、玻璃棒;
(4)加入少量硫酸可以调节pH为1~2是抑制亚铁离子和铵根离子水解,Fe2++2H2O?Fe (OH)2+2H+; NH4++H2O?NH3?H2O+H+;加入硫酸保持酸性,抑制Fe2+、NH4+离子的水解得到更多的产品;
故答案为:Fe2++2H2O?Fe (OH)2+2H+; NH4++H2O?NH3?H2O+H+;加入硫酸保持酸性,抑制Fe2+、NH4+离子的水解,得到更多的产品;
(5)加入的硫酸物质的量=0.05L×2mol/L=0.1mol,反应生成亚铁离子物质的量为0.1mol,理论上生成亚铁离子物质的量为0.1mol,生成硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O 物质的量为0.1mol,质量为0.1mol×392g/mol=39.2g;
故答案为:39.2;
(6)在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,铜离子氧化亚铁离子为硫酸根离子,反应的离子方程式为:2Cu2++SO32-+2Cl-+H2O
 2CuCl↓+SO42-+2H+;
2CuCl↓+SO42-+2H+;故答案为:2Cu2++SO32-+2Cl-+H2O
 2CuCl↓+SO42-+2H+;
2CuCl↓+SO42-+2H+;点评:本题考查了物质制备实验分析判断,物质分离和提纯的方法应用,实验过程分析和物质性质掌握是解题关键他们难道中等.

亚铁盐中,FeSO4•7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4•FeSO4•6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4•FeSO4•6H2O。
实验室用废铁屑制备莫尔盐的过程如下:

(1)步骤I除锈的操作是:将废铁屑放入烧杯, ,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、 。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]= 。
为了确定(NH4)2SO4的用量,下列方法简便可行的是 (填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组 设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
|
序号 |
实验方案 |
实验现象和结论 |
|
步骤1 |
取少量样品 |
样品颜色可能有变化。 |
|
步骤2 |
步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 |
若 ,说明样品中含有FeSO4·7H2O杂质。 |
|
步骤3 |
若步骤2证明样品不含FeSO4•7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 |
若w1 w2,说明样品中含有(NH4)2SO4杂质。 |
(已知(NH4)2SO4•FeSO4•6H2O的式量为392,(NH4)2SO4的式量为132)