题目内容
某反应体系中的物质有:A1203、AlN、C、N2、C02
(1)请将A1203之外的反应物和生成物分别填入以下空格中
(2)当体系中有6mol还原剂被氧化时,转移
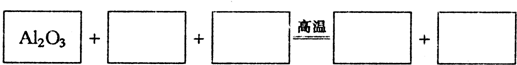
(1)请将A1203之外的反应物和生成物分别填入以下空格中
(2)当体系中有6mol还原剂被氧化时,转移
24mol
24mol
.
分析:(1)A12O3是反应物,反应中A12O3→AlN,Al元素化合价不变化,根据氮元素守恒知N2是反应物,反应中N2→AlN,N元素的化合价降低,根据电子转移守恒可知C是反应物,CO2是生成物,反应中N2→AlN,N元素的化合价由0价降低为-3价,共降低6价,C→CO2,C元素化合价由0价升高为+4价,共升高4价,化合价升降最小公倍数为12,故N2系数为2,C系数为3,根据元素守恒确定其它物质的系数,从而配平书写方程式;
(2)反应中C→CO2,C元素化合价由0价升高为+4价,C是还原剂,转移电子的物质的量为C的4倍.
(2)反应中C→CO2,C元素化合价由0价升高为+4价,C是还原剂,转移电子的物质的量为C的4倍.
解答:解:(1)A12O3是反应物,反应中A12O3→AlN,Al元素化合价不变化,根据氮元素守恒知N2是反应物,反应中N2→AlN,N元素的化合价降低,根据电子转移守恒可知C是反应物,CO2是生成物,反应中N2→AlN,N元素的化合价由0价降低为-3价,共降低6价,C→CO2,C元素化合价由0价升高为+4价,共升高4价,化合价升降最小公倍数为12,故N2系数为2,C系数为3,再结合原子守恒配平方程式,所以该反应方程式为2Al2O3+2N2+3C
4AlN+3CO2.
故答案为:2N2;3C;4AlN;3CO2;
(2)反应中C→CO2,C元素化合价由0价升高为+4价,C是还原剂,体系中有6mol还原剂被氧化时,转移电子为6mol×4=24mol,故答案为:24.
| ||
故答案为:2N2;3C;4AlN;3CO2;
(2)反应中C→CO2,C元素化合价由0价升高为+4价,C是还原剂,体系中有6mol还原剂被氧化时,转移电子为6mol×4=24mol,故答案为:24.
点评:本题考查了氧化还原反应中反应物和生成物的判断、反应方程式的配平、物质的量的计算等知识点,要根据元素化合价变化来判断反应物和生成物,再结合转移电子守恒、原子守恒配平方程式,难度中等.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
