题目内容
有不同浓度的NaOH溶液各取100mL分别通入SO2 1.12L(标准状况),完全反应后,用N2吹干水分得到不含结晶水的固体质量分别为6g和7g,求这两种NaOH溶液的物质的量浓度.
解析:
|
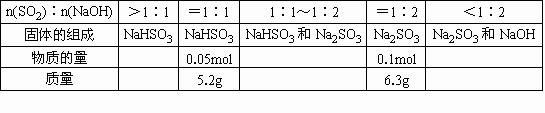
【解答】这两种NaOH的物质的量浓度分别为0.86mol/L和1.175mol/L. 【巧解导析】可能的反应有 NaOH+SO2=NaHSO3[n(SO2)∶n(NaOH)=1∶1] 2NaOH+SO2=Na2SO3+H2O[n(SO2)∶n(NaOH)=1∶2] 吹干后固体的质量与n(SO2)∶n(NaOH)的关系可列表如下:
由上表可知当n(SO2)∶n(NaOH)>1∶1时,吹干后所得固体的质量应小于5.2g,因SO2未被全部吸收(过量).当固体质量为6g时,其组成为NaHSO3+Na2SO3,当固体质量为7g时,其组成为Na2SO3+NaOH. (1)当固体质量为6g时,其组成为NaHSO3和Na2SO3,此时n(NaOH)>n(H2S),这些NaOH可分为两部分,0.05mol NaOH与SO2反应生成NaHSO3,其质量为5.2g,剩余的NaOH与产物NaHSO3反应. NaHSO3+NaOH=Na2SO3+H2O Δm(质量增加) 104 126 126-104=22 x 6-5.2=0.8 得x=3.744g,即物质的量为0.036mol,因此NaOH共为 0.05+0.036=0.086mol, 其浓度为 (2)当固体质量为7g时,n(NaOH)>0.1mol,可分为两部分:0.1mol NaOH先生成Na2SO3 6g,然后过量的NaOH不反应,吹干时不反应,使总质量净增到7g,净增部分的NaOH为 |
提示:
|
【巧解点悟】该题给人感觉好像条件太少,但当能正确地判断固体的组成和生成条件时,便可迎刃而解了.题中用N2吹干的目的在于避免NaHSO3的分解以及NaOH与CO2的反应,起到保护的作用. |

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案随着溶液酸碱性的变化,酚酞分子结构发生转化而显示不同颜色:
无色酚酞结构A![]() 红色酚酞结构B。在化学实验课上,细心的某同学发现:当无色的酚酞溶液滴入到氢氧化钠溶液中时,溶液立刻变成红色,但是随后红色溶液又逐渐变成无色。对此,许多同学纷纷发表看法,主要有三种推测:
红色酚酞结构B。在化学实验课上,细心的某同学发现:当无色的酚酞溶液滴入到氢氧化钠溶液中时,溶液立刻变成红色,但是随后红色溶液又逐渐变成无色。对此,许多同学纷纷发表看法,主要有三种推测:
①红色酚酞结构被空气中的氧气氧化;
②溶液吸收了空气中的二氧化碳,pH减小,红色褪去;
③红色酚酞结构自动转化为另外一种无色酚酞结构C。
为此在老师的指导下,同学们做了如下实验。分别取4 mL不同浓度的NaOH溶液于试管中,滴加2滴酚酞溶液,实验现象与数据如下表:
| 编号 | 静置方式 | NaOH溶液浓度 | 滴入2滴酚酞溶液 | 加热至沸腾 | 冷却 | 再加热至沸腾 | 冷却 | 滴入适量稀盐酸 |
| ① | 敞口 | 1% | 变红,30 min后褪色 | 变红 | 褪色 | 变红 | 褪色 | 变红 |
| ② | 密闭 | 1% | 变红,29 min后褪色 | 变红 | 褪色 | 变红 | 褪色 | 变红 |
| ③ | 敞口 | 5% | 变红, 7 min后褪色 | 变红 | 褪色 | 变红 | 褪色 | 变红 |
| ④ | 密闭 | 5% | 变红,30 min后褪色 | 变红 | 褪色 | 变红 | 褪色 | 变红 |
| ⑤ | 敞口 | 10% | 变红,1/2 min后褪色 | 变红 | 褪色 | 变红 | 褪色 | 变红 |
| ⑥ | 密闭 | 10% | 变红,1/2 min后褪色 | 变红 | 褪色 | 变红 | 褪色 | 变红 |
请回答下列问题:?
(1)通过分析表中数据及现象,该组同学认为第①种推测 合理。(填是、否)
(2)第②种推测 合理。(填是、否)
(3)红色酚酞结构B转化为无色酚酞结构C是否为可逆反应: (填是、否);在各个滴入适量稀盐酸又变红的试管中加入足量稀盐酸产生的现象是 。
(4)红色酚酞结构B的热稳定性比无色酚酞结构C的热稳定性要 (填“强”或“弱”),红色酚酞结构B转化为无色酚酞结构C是一个 (填“吸”或“放”)热的过程。
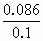 =0.86mol/L.
=0.86mol/L. =0.0175mol,故NaOH总共0.1175mol,物质的量浓度为1.175mol/L.
=0.0175mol,故NaOH总共0.1175mol,物质的量浓度为1.175mol/L.