题目内容
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%—5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。[探究一]
实验方案:铝镁合金![]() 测定剩余固体质量
测定剩余固体质量
实验中发生反应的化学方程式是______________________。
实验步骤:(1)称取
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_________(填“偏高”或“偏低”)。
[探究二]
实验方案:铝镁合金![]() 测定生成气体的体积
测定生成气体的体积
实验装置:

问题讨论:(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是_____________。(填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①_______________________________,②________________________________。
[探究三]
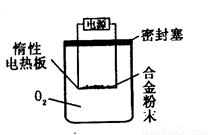
实验方案:称量x g铝镁合金粉末,放在如下图所示装置的惰性电热板上,通电使其充分灼烧。

问题讨论:(1)欲计算Mg的质量分数,该实验中还需测定的数据是____________。
(2)若用空气代替O2进行实验,对测定结果是否有影响?___________(填“是”或“否”)。
[实验拓展]
参照探究一、探究二的实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。
____________________________________________________________________。
[探究一]2Al+2NaOH+2H2O====2NaAlO2+3H2↑
(1)97 mL (2)偏高
[探究二](1)不需要
(2)检查装置的气密性 合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平等合理答案)
[探究三](1)灼烧后固体的质量
(2)是
[实验拓展]铝镁合金![]() 溶液
溶液![]() 测定固体质量
测定固体质量
(或铝镁合金![]() 溶液
溶液![]() 测定固体质量等合理答案)
测定固体质量等合理答案)
解析:[探究一]Mg不与NaOH溶液反应,故剩余固体为Mg,Al与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O====2NaAlO2+3H2↑。![]() =97 mL。若未洗涤固体,则固体上附着些杂质导致镁的质量分数将偏高。[探究二]本方案是通过排水法测定生成气体的体积从而测定Mg的质量分数,故而不需要干燥和除HCl气体的装置。[探究三]Mg、Al分别与O2反应所得产物为MgO、Al2O3,欲计算Mg的质量分数,还需测定产物的质量。若用空气代替O2进行实验,空气中的CO2会与Mg反应,将会使所得固体质量增加,对测定结果有影响,[实验拓展]探究一、探究二是让合金分别与盐酸、NaOH溶液反应,那么,另设计实验方案时可将两者综合运用。
=97 mL。若未洗涤固体,则固体上附着些杂质导致镁的质量分数将偏高。[探究二]本方案是通过排水法测定生成气体的体积从而测定Mg的质量分数,故而不需要干燥和除HCl气体的装置。[探究三]Mg、Al分别与O2反应所得产物为MgO、Al2O3,欲计算Mg的质量分数,还需测定产物的质量。若用空气代替O2进行实验,空气中的CO2会与Mg反应,将会使所得固体质量增加,对测定结果有影响,[实验拓展]探究一、探究二是让合金分别与盐酸、NaOH溶液反应,那么,另设计实验方案时可将两者综合运用。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

 问题讨论:
问题讨论:
 测定剩余固体质量。
测定剩余固体质量。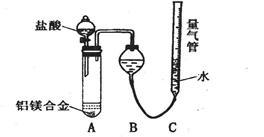
 测定生成气体的体积实验装置。
测定生成气体的体积实验装置。
 测定生成气体的体积
测定生成气体的体积