题目内容
下列化学实验图示正确的是( )
A、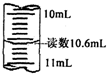 滴定管读数 | B、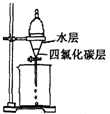 分液操作 | C、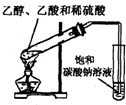 乙醇和乙酸反应 | D、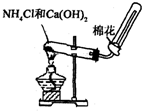 实验室制取氨气 实验室制取氨气 |
分析:A、滴定管读数应该读到0.01mL;
B、分液操作中分液漏斗的下端应该靠在烧杯的内壁;
C、酯化反应中应该使用浓硫酸;
D、根据实验室制取氨气的实验原理和实验装置进行判断.
B、分液操作中分液漏斗的下端应该靠在烧杯的内壁;
C、酯化反应中应该使用浓硫酸;
D、根据实验室制取氨气的实验原理和实验装置进行判断.
解答:解:A、根据图示滴定管中液面可知,溶液的体积读数为10.60mL,故A错误;
B、在分液操作时,分液漏斗的下端应该靠在烧杯内壁,故B错误;
C、乙酸和乙醇的酯化反应中,应该使用浓硫酸做吸水剂、催化剂,不能使用稀硫酸,故C错误;
D、实验室利用氯化铵和氢氧化钙固体加热制取少量的氨气,图示装置和样品都合理,故D正确;
故选D.
B、在分液操作时,分液漏斗的下端应该靠在烧杯内壁,故B错误;
C、乙酸和乙醇的酯化反应中,应该使用浓硫酸做吸水剂、催化剂,不能使用稀硫酸,故C错误;
D、实验室利用氯化铵和氢氧化钙固体加热制取少量的氨气,图示装置和样品都合理,故D正确;
故选D.
点评:本题考查了计量仪器的使用方法、酯化反应条件、分液操作方法、实验室制取氨气装置及原理,题目难度中等,涉及的知识点较多,充分考查了学生对基础知识的掌握情况,培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目