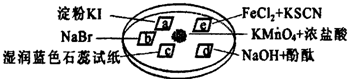
题目内容
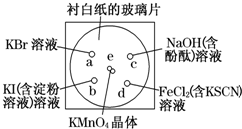 如图所示是验证氯气性质的微型实验,玻璃片上有a、b、c、d四滴溶液,向e处KMnO4晶体滴加一滴浓盐酸后,立即用一培养皿扣在玻璃片上.已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.下列有关说法不正确的是( )
如图所示是验证氯气性质的微型实验,玻璃片上有a、b、c、d四滴溶液,向e处KMnO4晶体滴加一滴浓盐酸后,立即用一培养皿扣在玻璃片上.已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.下列有关说法不正确的是( )| A、上述生成Cl2的反应中,HCl既表现出酸性又表现出还原性 | B、反应后a处呈橙色、b处呈蓝色、c处褪色、d处呈血红色 | C、a、b两处的颜色变化,证明单质氧化性:Cl2>Br2>I2 | D、d处的颜色变化,证明氧化性:Cl2>Fe3+;还原性:Cl-<Fe2+ |
分析:Cl2分别与KI、KBr作用生成I2、Br2,a处变橙色,b处变蓝,可证明氧化性:Cl2>I2、Cl2>Br2,无法证明I2与Br2之间氧化性的强弱;C处氯气会和氢氧化钠之间反应,碱性减弱直至消失,d处,氯气能将亚铁离子氧化为三价铁离子,三价铁离子遇到硫氰酸钾显示红色,据此来回答即可.
解答:解:A、反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,生成氯化锰和氯化钾体现了盐酸的酸性,生成氯气体现了盐酸的还原性,故A正确;
B、Cl2分别与KI、KBr作用生成I2、Br2,a处变橙色,b处变蓝,C处氯气会和氢氧化钠之间反应,碱性减弱直至消失,所以会褪色,d处,氯气能将亚铁离子氧化为三价铁离子,三价铁离子遇到硫氰酸钾显示红色,故B正确;
C、Cl2分别与KI、KBr作用生成I2、Br2,a处变橙色,b处变蓝,可证明氧化性:Cl2>I2、Cl2>Br2,无法证咒C.明I2与Br2之间氧化性的强弱,故C错误;
D、d处,氯气能将亚铁离子氧化为三价铁离子,证明氧化性:Cl2>Fe3+,则还原性:Cl-<Fe2+,故D正确.
故选C.
B、Cl2分别与KI、KBr作用生成I2、Br2,a处变橙色,b处变蓝,C处氯气会和氢氧化钠之间反应,碱性减弱直至消失,所以会褪色,d处,氯气能将亚铁离子氧化为三价铁离子,三价铁离子遇到硫氰酸钾显示红色,故B正确;
C、Cl2分别与KI、KBr作用生成I2、Br2,a处变橙色,b处变蓝,可证明氧化性:Cl2>I2、Cl2>Br2,无法证咒C.明I2与Br2之间氧化性的强弱,故C错误;
D、d处,氯气能将亚铁离子氧化为三价铁离子,证明氧化性:Cl2>Fe3+,则还原性:Cl-<Fe2+,故D正确.
故选C.
点评:本题通过元素化合物知识,考查考生实验能力和对实验现象的分析、推断能力,题目难度中等,注意把握氯气以及其它物质的相关化学性质,把握离子检验方法和特征反应的现象是关键.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目