题目内容
A、B、C、D四种短周期主族元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为l:1和1:2的两种离子化合物甲和乙,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)写出元素符号:B ,D ;
(2)甲物质的电子式是 ;
(3)用电子式表示乙物质的形成过程 ;
(4)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式: ;
(5)A、B、C、D四种元素的原子半径由小到大的顺序是 (用元素符号填写).
(1)写出元素符号:B
(2)甲物质的电子式是
(3)用电子式表示乙物质的形成过程
(4)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
(5)A、B、C、D四种元素的原子半径由小到大的顺序是
分析:A、B、C、D四种短周期主族元素,原子序数依次增大,A、C能形成1:1和1:2两种离子化合物甲和乙,故:A为O,C为Na,甲为Na2O2,乙为Na2O,A、B、C、D形成离子半径依次减小,结合原子序数可知,应为电子层结构相同的离子,A与D的原子序数之和等于B与C的原子序数之和,则原子序数D-B=C-A=11-8=3,可推知D为Mg,B为F,据此解答.
解答:解:A、B、C、D四种短周期主族元素,原子序数依次增大,A、C能形成1:1和1:2两种离子化合物甲和乙,故:A为O,C为Na,甲为Na2O2,乙为Na2O,A、B、C、D形成离子半径依次减小,结合原子序数可知,应为电子层结构相同的离子,A与D的原子序数之和等于B与C的原子序数之和,则原子序数D-B=C-A=11-8=3,可推知D为Mg,B为F,
(1)通过以上分析知,B是F元素,D是Mg元素,故答案为:F;Mg;
(2)甲为Na2O2,由钠离子与过氧根离子构成,过氧根离子中O原子之间形成1对共用电子对,且O原子满足8电子结构,故过氧化钠的电子式为: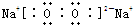 ,故答案为:
,故答案为: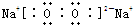 ;
;
(3)乙为Na2O,用电子式表示其形成过程为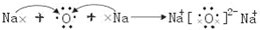 ,
,
故答案为: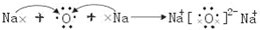 ;
;
(4)A、C形成的离子化合物能和二氧化碳发生氧化还原反应,则该离子化合物是Na2O2,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(5)同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Mg>O>F,故答案为:Na>Mg>O>F.
(1)通过以上分析知,B是F元素,D是Mg元素,故答案为:F;Mg;
(2)甲为Na2O2,由钠离子与过氧根离子构成,过氧根离子中O原子之间形成1对共用电子对,且O原子满足8电子结构,故过氧化钠的电子式为:
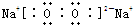 ,故答案为:
,故答案为: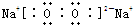 ;
;(3)乙为Na2O,用电子式表示其形成过程为
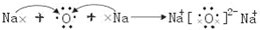 ,
,故答案为:
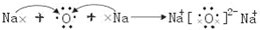 ;
;(4)A、C形成的离子化合物能和二氧化碳发生氧化还原反应,则该离子化合物是Na2O2,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(5)同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Mg>O>F,故答案为:Na>Mg>O>F.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握半径比较、用电子式表示化学键及物质的形成,难度中等.

练习册系列答案
相关题目
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比3:4,D分别与A、B、C可形成10个电子的分子X、Y、Z.则下列叙述正确的是( )
| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |

 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.