题目内容
下列各组物质由于浓度不同而能发生不同氧化还原反应的是( )
①Cu与HNO3溶液;②NaOH与AlCl3溶液;③Zn与H2SO4溶液;④Na与O2反应
①Cu与HNO3溶液;②NaOH与AlCl3溶液;③Zn与H2SO4溶液;④Na与O2反应
| A.①③ | B.①②③ | C.②③④ | D.①④ |
A
①3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,符合题意
②两者发生的反应为非氧化还原反应,不符合题意
③Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O Zn+H2SO4(浓)=ZnSO4+H2↑
④两者在常温或点燃的情况下,发生不同的氧化还原反应,并非浓度不同,不符合题意
答案为A
②两者发生的反应为非氧化还原反应,不符合题意
③Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O Zn+H2SO4(浓)=ZnSO4+H2↑
④两者在常温或点燃的情况下,发生不同的氧化还原反应,并非浓度不同,不符合题意
答案为A

练习册系列答案
相关题目
 铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)
铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) O
O 。
。 。
。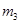 。
。 (碱式硫酸铁),该反应的化学方程式为 。
(碱式硫酸铁),该反应的化学方程式为 。 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( ) 的是
的是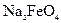 )对河水、湖水消毒是城市饮水处理的新技术。已知反应为:
)对河水、湖水消毒是城市饮水处理的新技术。已知反应为:  ,下列说法正确的是
,下列说法正确的是 既是氧化剂又是还原剂
既是氧化剂又是还原剂