题目内容
某化学学习小组欲探究铁及其化合物的氧化性和还原性。请你协助他们完成实验报告。
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是 。
| 序号 | 实验设计 | 实验观察(主要现象) | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴 入稀硫酸 | 铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的的气体生成 | Fe +2H+= H2↑+ Fe2+ | Fe具有还原性 |
| ② | 氯化亚铁溶液中滴入KSCN溶液,再加入氯水 | 滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 | | |
| ③ | 氯化亚铁溶液加 入锌片 | | Fe2++ Zn =" Fe" + Zn 2++ | |
| ④ | | | | Fe3+具有氧化性 |
(3)实验记录(在仿照①实验作答,划线部分不必填写)
(4)学习小组的同学将从本实验中获得的知识推广到其他类物质的学习,请判断下列物质既有氧化性又有还原性的是
A、Cl2 B、Na C、Mg2+ D、H2O2
(5)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,你认为是什么原因: ;
你将对实验员在配制氯化亚铁溶液时,提出的建议是 。
(6)在配制氯化铁溶液时,由于实验员失误,可能导致溶液中含有少量的Fe2+,为帮助实验员进行检验少量Fe2+的存在,请从下列物质中选择合适的试剂( )
A、KSCN溶液 B、稀盐酸 C、KMnO4溶液 D、NaOH溶液
(2)试管 (1分)
(3)②2Fe2+ +Cl2=2Fe3+ +2 Cl-(1分)、Fe3++3SCN- = Fe(KSCN)3(1分);Fe2+具有还原性(1分)
③ Fe2+具有氧化性(1分)
④在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片);(1分)
加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失(1分)。
(或先加入足量Cu片(或铁粉或锌片),再加入KSCN溶液,无血红色出现);
2Fe3+ +Cu = 2Fe2+ + Cu2+ 或2Fe3+ +Fe = 3Fe2+或2Fe3+ + Zn = 2Fe2+ + Zn 2+或
2Fe3+ + 3Zn = 2Fe+3 Zn 2+(1分)
(4)AD (2分)
(5)氯化亚铁溶液中的Fe2+被氧化(2分);配制氯化亚铁溶液时要加入少量的铁粉(2分)。
(6)C(2分)
解析试题分析:(2)还缺反应容器:试管。
(3)②加入氯水后,Cl2把Fe2+氧化为Fe3+,离子方程式为:2Fe2+ +Cl2=2Fe3+ +2 Cl-,Fe3+与SCN?发生络合反应:Fe3++3SCN- = Fe(KSCN)3,说明Fe2+具有还原性。
③Fe2++ Zn =" Fe" + Zn 2+反应中,Fe元素的化合价降低,说明Fe2+具有氧化性。
④要证明Fe3+具有氧化性,先加入KSCN溶液,溶液变红,再加入还原剂,如Cu片(或铁粉或锌片),红色消失,说明Fe3+具有氧化性,根据选择的试剂写出离子方程式。
(4)元素化合价处于中间价态的物质,既有氧化性也有还原性,Cl2、H2O2中Cl元素和O元素处于中间价态,这两种物质既有氧化性也有还原性,故A项、D项正确。
(5)在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,是因为Fe2+具有还原性,被氧化为Fe3+;配制氯化亚铁溶液时加入少量的铁粉,可防止Fe2+被氧化。
(6)Fe2+具有还原性,可使KMnO4溶液褪色,故C项正确。
考点:本题考查实验仪器的选择、离子的检验、离子方程式的书写、实验方案的设计与分析、 物质氧化性和还原性的判断。

某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。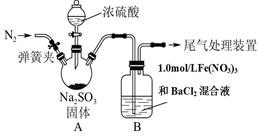
请回答:
(1)装置A中用于添加浓硫酸的仪器名称为 。
(2)实验前鼓入N2的目的是 。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是 。
②按观点2,装置B中反应的离子方程式是 ,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号) 。
| A.1 mol/L稀硝酸 |
| B.1.5 mol/L Fe(NO3)2溶液 |
| C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
| D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I—能被NO3-离子氧化成IO3-离子,被H2O2或O2等氧化成I2;②IO3-离子能被HSO3-离子还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3-中的哪一种。
限选试剂如下:1.0 mol?L-1HNO3溶液、1.0 mol?L-1 H2SO4溶液、1.0 mol?L-1NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2 ;
假设2:该食盐样品中含I—
假设3: 。
Ⅱ.设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡。 | 若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ;否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源。从化学角度来看,试验中添加 (填“KIO3”或“KI”)更好;理由是 。
下列说法中不正确的是 ( )
| A.向滴有酚酞的水中加入过量Na2O2粉末并振荡,溶液由无色变红又变无色 |
| B.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应是一个放热反应且有氧气生成 |
| C.Na2O2与H2O反应是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂 |
| D.Na2O2与H2O反应是一个置换反应,有单质O2产生 |
海水提镁的主要流程如下: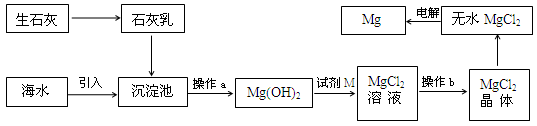
下列说法正确的是
①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤电解熔融MgCl2比电解熔融的MgO制金属镁更节约能量
| A.①②③④⑤ | B.②③ | C.④⑤ | D.①④⑤ |
某温度下,w克某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w克。在①H2 、②CO、 ③CO和H2的混合气、④C6H12O6中( )
| A.均不符合 | B.只有①② | C.只有①②③ | D.全部符合 |
下列反应所得溶液中一定只含一种溶质的是
| A.向AlCl3溶液中滴入NaOH溶液 | B.向NaOH溶液中通入SO2气体 |
| C.向稀硝酸中加入过量铁粉 | D.向Na2CO3溶液中滴入盐酸 |
 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH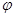 (CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。
(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。