题目内容
可逆反应A(g)+3B(g) 2C(g) ΔH=-QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是
2C(g) ΔH=-QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是
A.甲中A的转化率为75% B.Q1+Q2=Q
C.达到平衡后,再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向正向移动
D.乙中的热化学方程式为2C(g) A(g)+3B(g) ΔH=+Q2 kJ/mol
A(g)+3B(g) ΔH=+Q2 kJ/mol
D
解析试题分析:由Q1=3Q2可知△n甲(A)=3△n乙(A),则:
甲 A(g)+3B(g)  2C(g)
2C(g)
起始量(mol) 1 3 0
转化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
乙 A(g)+3B(g)  2C(g)
2C(g)
起始量(mol) 0 0 2
转化量(mol)  x
x 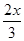
平衡量(mol)  x 2-
x 2-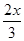
利用“一边倒法”,可知“1 mol A、3 mol B”与“2 mol C”是等效物料,它们在同温同容的条件下建立的平衡状态完全相同,则1-x= ,解得x=0.75,所以α(A)=
,解得x=0.75,所以α(A)=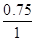 ×100%=75%,因此A正确;B、Q1+Q2=0.75Q+
×100%=75%,因此A正确;B、Q1+Q2=0.75Q+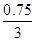 Q=Q,所以B正确;C、利用“一边倒法”,可知再加入“0.25 mol A、0.75 mol B、1.5 mol C”与再加入“2 mol C”等效,在恒温恒容条件下相当于增大压强,平衡向生成C的方向移动,故C正确;D、乙中反应掉的C为
Q=Q,所以B正确;C、利用“一边倒法”,可知再加入“0.25 mol A、0.75 mol B、1.5 mol C”与再加入“2 mol C”等效,在恒温恒容条件下相当于增大压强,平衡向生成C的方向移动,故C正确;D、乙中反应掉的C为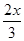 mol=0.50mol,所给热化学方程式中2 mol C对应的反应热应为+4Q2 kJ?mol-1,故D错误,答案选D。
mol=0.50mol,所给热化学方程式中2 mol C对应的反应热应为+4Q2 kJ?mol-1,故D错误,答案选D。
考点:考查等效平衡的应用、反应热的计算以及可逆反应的有关计算等

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案已建立化学平衡的某可逆反应X(g)+2Y(g)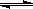 2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
①生成物的质量分数一定增加,②生成物总量一定增加, ③反应物的转化率一定增大,
④反应物的浓度一定降低,⑤正反应速率一定大于逆反应速率,⑥一定使用催化剂
| A.①②③ | B.③④⑤ | C.②⑤ | D.④⑥ |
下列说法正确的是
| A.增大体系压强,活化分子数增加,化学反应速率一定增大 |
| B.加入反应物,使活化分子百分数增加,化学反应速率增大 |
| C.活化分子间所发生的分子间的碰撞均为有效碰撞 |
| D.升高温度,活化分子百分数增加,化学反应速率一定增大 |
活化分子是衡量化学反应速率快慢的重要依据,下列对活化分子说法中不正确的是( )
| A.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
| B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快 |
| C.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子增多,反应速率加快 |
| D.活化分子之间的碰撞一定是有效碰撞 |
化学平衡常数(K)是化学反应限度的一个重要参数,该常数表示的意义是可逆反应进行的程度,K值越大,表示的意义错误的是( )
| A.温度越高 | B.反应物浓度越小 |
| C.反应进行的越完全 | D.生成物浓度越大 |
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)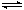 CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是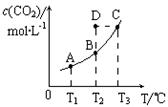
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的△H>0 CO2(g)+H2(g)的△H>0 |
| B.在T2时,若反应进行到状态D,则一定有v正<v逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.由D状态转变为C状态后,混合气体的平均相对分子质量不变 |
下列各组Na2S2O3溶液跟稀H2SO4反应的实验中,溶液中最先变浑浊的是
| 选项 | 反应 温度 | 反 应 物 | H2O | |||
| Na2S2O3 | H2SO4 | |||||
| t(℃) | V(mL) | c(mol×L-1) | V(mL) | c(mol×L-1) | V(mL) | |
| A | 10 | 5 | 0.1 | 10 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 30 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 35 |
一定条件下,在固定容积密闭容器中发生可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
| A.达到化学平衡时,化学反应速率的关系是2v逆(NH3)=3v正 (H2O) |
| B.达到化学平衡时,NH3、O2、NO、H2O物质的量之比为4∶5∶4∶6 |
| C.混合气体的密度一定时,该化学反应达到化学平衡 |
| D.若单位时间内生成x mol NO的同时,生成x mol NH3,则反应达到平衡状态 |
 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是