题目内容
密度为0.478 g·L-1的C2H2、C2H4、H2的混合气体,通过镍催化剂后,密度增大到1.062 g·L-1(密度均在标准状况下换算),试求原混合气体中各种气体的体积分数。
C2H4为15%,C2H2为20%,H2为65%。
解析:
烯烃、炔烃在一定条件下均能发生加成反应。从解题过程可知假设未知数对解题有时会起到很重要的作用。
C2H2、C2H4均能与H2反应,由ρ=![]() ,可知气体总质量保持不变,ρ增大,说明反应后的体积比原来更小。
,可知气体总质量保持不变,ρ增大,说明反应后的体积比原来更小。
反应后混合气体的M=1.062 g·L-1×22.4 L·mol-1=23.8 g·mol-1。由于C2H2、C2H4、C2H6的相对分子质量分别是26、28、30,说明反应后混合气体中还有H2,反应前H2过量,反应后混合气体是由C2H6和H2组成的。
C2H4+H2![]() C2H6 C2H2+2H2
C2H6 C2H2+2H2![]() C2H6
C2H6
设反应后H2的体积分数为x,则C2H6的体积分数为(1-x),依题意:
2x+30(1-x)=23.8
解得x=0.221。
又设反应前混合气体体积是A,则同温同压下反应后的气体体积应为
![]() =0.45A
=0.45A
反应后,H2的体积为0.45A×0.221=0.1A
则C2H6为0.35A。
再设反应前混合气体中C2H4、C2H2、H2的体积分别为a、b、c,根据化学反应方程式有
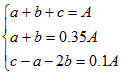 得a=0.15A,b=0.2A,c=0.65A。
得a=0.15A,b=0.2A,c=0.65A。
所以,原混合气体中C2H4、C2H2、H2的体积分数分别为15%、20%和65%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目