题目内容
(每空2分,共16分)依据事实,填空:
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式: 正极: ;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
该反应的反应方程式可表示为 ,平衡时Y气体的转化率 。
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为 ;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量 。
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式: 正极: ;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为 ;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量 。
(1) CH3OH(l)+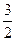 O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
(2)N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1
(3)O2+2H2O+4e-==4OH- 2H2+4OH--4e-==4H2O
(4) X+3Y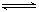 2Z 75%
2Z 75%
(5) 40 ; 18mol
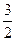 O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1(2)N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1
(3)O2+2H2O+4e-==4OH- 2H2+4OH--4e-==4H2O
(4) X+3Y
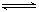 2Z 75%
2Z 75%(5) 40 ; 18mol
略

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
 4NO(g)+6H2O(g)下列叙述正确的是( )。
4NO(g)+6H2O(g)下列叙述正确的是( )。 Z达到平衡时,下列各种说法错误的是( )
Z达到平衡时,下列各种说法错误的是( )
 2HBr(g),达到平衡的标志是
2HBr(g),达到平衡的标志是 2C(g)+2D(g)达到平衡状态的是
2C(g)+2D(g)达到平衡状态的是 2NH3,下列说法正确的是
2NH3,下列说法正确的是