题目内容
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的
实验装置。
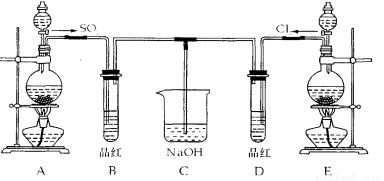
(1)实验室用装置A制备SO2某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未
流下,你认为原因可能是:
(2)实验室用装置E制备Cl2其反应的化学化学方程式为:MnO2+4HCl(浓)=C12↑+MnCl2+2H2O
浓盐酸的作用为:
(3)反应开始一段时间后,观察到 B、D两个试管中的品红溶液出现的现象是:
B: D 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B: D 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性.二者混合后的漂白性肯定会更强。他们将制得的SO2和CI2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示): 。
(1)分液漏斗的玻璃塞没有取下来(2分)
(2)酸性(1分),还原剂 (1分)
(3)① 品红褪色(1分) 品红褪色(1分)
②褪色的品红又恢复成红色(1分) 溶液没有恢复成红色(1分)
(4)Cl2+SO2+2H2O=2HCl+H2SO4 (2分)
【解析】
试题分析:(1)打开A的分液漏斗活塞后,漏斗中液体未流下,可能原因是分液漏斗的玻璃塞没有取下来,
(2)浓盐酸与二氧化锰反应除了被氧化成氯气外还生成铝盐和水,所以浓盐酸的作用为酸性、还原剂
(3)①二氧化硫具有漂白作用,能使品红褪色,所以B中品红褪色;氯气与水反应生成的次氯酸具有强氧化性,可以氧化品红使品红褪色,所以D中品红也褪色
②二氧化硫的漂白使品红褪色是暂时的,加热后品红又变成红色,而次氯酸使品红褪色是永久的,加热也不恢复,所以D中溶液没有恢复成红色
(4)氯水与二氧化硫混合会发生氧化还原反应彼此都失去了漂白作用,化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4
考点:考查二氧化硫与氯水的漂白作用的区别

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g·mol-1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.075 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)配制一定物质的量浓度的上述“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、_________、________。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是 。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol/L。