题目内容
将6.4 g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余。试计算:(要求有计算过程)
(1)生成的SO2的体积(标准状况下)。
(2)若用4 mol·L-1的NaOH溶液吸收生成的SO2 ,恰好生成Na2SO3 ,计算需要NaOH溶液的体积。
(1)生成的SO2的体积(标准状况下)。
(2)若用4 mol·L-1的NaOH溶液吸收生成的SO2 ,恰好生成Na2SO3 ,计算需要NaOH溶液的体积。
(1)2.24 L (2分)
(2)0.05 L或50 mL (2分)
(2)0.05 L或50 mL (2分)
试题分析:(1)6.4gCu的物质的量为0.1mol,根据Cu+2H2SO4(浓)
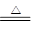 CuSO4+SO2↑+2H2O可知,n(SO2)=n(Cu)=0.1mol,故生成SO2的体积为0.1mol×22.4L/mol=2.24L,答:生成SO2的体积为2.24L;
CuSO4+SO2↑+2H2O可知,n(SO2)=n(Cu)=0.1mol,故生成SO2的体积为0.1mol×22.4L/mol=2.24L,答:生成SO2的体积为2.24L;(2)根据硫元素守恒可知n(Na2SO3)=n(SO2)=0.1mol,根据钠离子守恒可知
n(NaOH)=2n(Na2SO3)=0.2mol,故需要NaOH溶液的体积为0.05L,
答:需要NaOH溶液的体积为0.05L.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
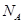 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是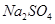 的溶液中含
的溶液中含
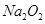 固体中含2
固体中含2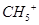 离子所含电子数为10
离子所含电子数为10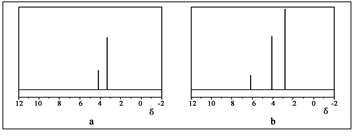
 H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。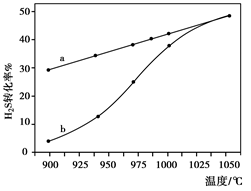

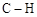 键数目为8 NA
键数目为8 NA