题目内容
将一定量的CO2气体通入500 mL某NaOH溶液中,充分反应后,将溶液在低温下蒸发,得到不含结晶水的白色固体A。取三份质量不同的A样品分别与50 mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示:组别 | 1 | 2 | 3 |
盐酸体积(mL) | 50 | 50 | 50 |
A的质量(g) | 3.80 | 6.20 | 7.20 |
气体体积( mL) | 896 | 1 344 | 1 344 |
(1)上表中第_______组数据表明加入的50 mL盐酸反应后有剩余,理由是_______________________。
(2)试通过计算,推断A的成分及各成分的质量分数。
思路解析:CO2和NaOH反应的生成物取决CO2量的多少,本题的生成物是Na2CO3或NaHCO3还可能是NaHCO3和Na2CO3的混合物。可由上表中产生CO2物质的量入手,列方程组解答本题。
三组实验中所加盐酸一样多,只有第一组产气少,所以过量的话只能是第一组。
答案:(1)1 同样50 mL盐酸,第1组产生CO2气体最少
(2)解:生成A的反应可能有
2NaOH + CO2![]() Na2CO3+ H2O①
Na2CO3+ H2O①
NaOH + CO2![]() NaHCO3②
NaHCO3②
据第1组生成CO2的物质的量=![]() =0.04 mol,判断出A为Na2CO3与NaHCO3的混合物。
=0.04 mol,判断出A为Na2CO3与NaHCO3的混合物。
设A含Na2CO3、NaHCO3的物质的量分别为x、ymol,得方程组:
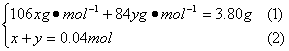
解得:x=0.02mol,y=0.02 mol
m(Na2CO3)=0.02 mol×
m(NaHCO3)=0.02 mol×
φ(Na2CO3)%=![]() =55.8%
=55.8%
φ(NaHCO3)%=![]() =44.2%
=44.2%

 阅读快车系列答案
阅读快车系列答案将一定量的CO2气体通入500mL某NaOH溶液中,充分反应后,将溶液在低温进行蒸发,得到不含结晶水的白色固体A。取三份质量不同的A样品分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示:
|
组 别 |
1 |
2 |
3 |
|
盐酸体积(mL) |
50 |
50 |
50 |
|
A的质量(g) |
3.80 |
5.70 |
7.60 |
|
气体体积(mL) |
896 |
1344 |
1344 |
(1)上表中第 组数据加入的50mL盐酸的反应后有剩余,
(2)试推断:A的成份为
(3)盐酸的物质的量的浓度为 mol·L-1
 将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).
将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).