题目内容
将等物质的量的F2和ClF混合,在密闭容器中发生反应:F2(g)+ClF(g)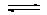 ClF3(g);△H<0。下列叙述中正确的是
ClF3(g);△H<0。下列叙述中正确的是
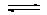 ClF3(g);△H<0。下列叙述中正确的是
ClF3(g);△H<0。下列叙述中正确的是| A.恒温恒容,当ClF 转化40% 时,容器内的压强为初始时的0.8 倍 |
| B.若 c(F2):c (ClF): c (ClF3) ="1:" 1: 1,则反应一定达到平衡状态 |
| C.平衡后,若增大容器容积,则正反应速率减小,逆反应速率增大,平衡左移 |
| D.平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量减小 |
A
A 正确依F2(g)+ClF(g) 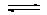 ClF3(g)转化1体积ClF(g)总体积减小1体积当有40%
ClF3(g)转化1体积ClF(g)总体积减小1体积当有40%
体积ClF(g)转化时可认为气体总体积减小0.4体积,那么反应达平衡时总体积为2-0.4=1.6体积容器内反应前后的压强比等于其体积比故1.6/2等于0.8
B 错误c(F2):c (ClF): c (ClF3) ="1:" 1: 1仅表示反应中反应物及生成物的量的关系,但不可看做达平衡状态的标志
C 错误达平衡后,若增大容器容积,反应混合物浓度均减小,正逆反应速率随之减小
D 错误平衡后再降低温度,保持恒容,平衡向放热反应方向移动即向正反应方向移动,气体物质的量减小,则混合气体的平均摩尔质量增大
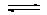 ClF3(g)转化1体积ClF(g)总体积减小1体积当有40%
ClF3(g)转化1体积ClF(g)总体积减小1体积当有40%体积ClF(g)转化时可认为气体总体积减小0.4体积,那么反应达平衡时总体积为2-0.4=1.6体积容器内反应前后的压强比等于其体积比故1.6/2等于0.8
B 错误c(F2):c (ClF): c (ClF3) ="1:" 1: 1仅表示反应中反应物及生成物的量的关系,但不可看做达平衡状态的标志
C 错误达平衡后,若增大容器容积,反应混合物浓度均减小,正逆反应速率随之减小
D 错误平衡后再降低温度,保持恒容,平衡向放热反应方向移动即向正反应方向移动,气体物质的量减小,则混合气体的平均摩尔质量增大

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
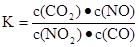 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是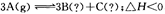 ,下列分析一定正确的是
,下列分析一定正确的是 pC(g)+qD(g)△H 的下列4个图象中,图象及对应解读均正确的是( )
pC(g)+qD(g)△H 的下列4个图象中,图象及对应解读均正确的是( )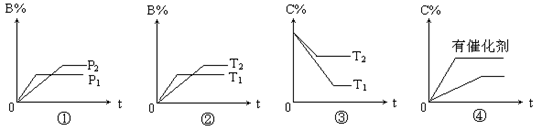
 10-19
10-19 ,2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:
,2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:
 C(g)+2D(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述一定正确的是
C(g)+2D(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述一定正确的是