题目内容
A的化学式为NH5,常温下呈固态,构成它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构.则下列有关说法中,不正确的是( )
| A、1mol NH5中含有5NA个N-H键(NA为阿佛加德罗常数的数值) | B、NH5中既有共价键,又有离子键 | C、它与水反应的化学方程式为:NH5+H2O═NH3?H2O+H2↑ | D、NH5的电子式为: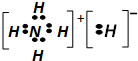 |
分析:固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,应为NH4H,是一种离子化合物,能与水反应:NH4H+H2O=NH3?H2O+H2↑,有氨气生成.
解答:解:A.根据氮原子的原子结构,最外层5个电子最多和四个氢原子形成共价键(其中一个是配位键,氮原子提供一对电子,氢离子提供空轨道形成),形成了带正电荷的铵根离子,所以另一个氢原子只能是形成H-,阴阳离子间形成离子键,故A错误;
B.NH5是离子化合物氢化铵,铵根中的氮原子与四个氢原子形成四个共价键,NH4+与H-之间为离子键,故B正确;
C.NH4H中含有-1价H,可与水发生氧化还原反应,方程式为NH4H+H2O=NH3?H2O+H2↑,故C正确;
D.根据离子化合物的结构特征,阳离子是铵根离子,阴离子是氢阴离子,都达到了稀有气体的最外层结构,电子式正确,故D正确.
故选A.
B.NH5是离子化合物氢化铵,铵根中的氮原子与四个氢原子形成四个共价键,NH4+与H-之间为离子键,故B正确;
C.NH4H中含有-1价H,可与水发生氧化还原反应,方程式为NH4H+H2O=NH3?H2O+H2↑,故C正确;
D.根据离子化合物的结构特征,阳离子是铵根离子,阴离子是氢阴离子,都达到了稀有气体的最外层结构,电子式正确,故D正确.
故选A.
点评:本题考查离子化合物的结构和性质,涉及原子间化学键的形成,原子最外层电子的稳定结构形成,电子式的书写等知识,为高频考点,注意把握题给信息,难度不大.

练习册系列答案
相关题目
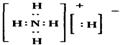 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,电子式为如图所示:下列说法正确的是( )
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,电子式为如图所示:下列说法正确的是( )