题目内容
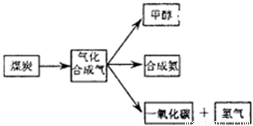
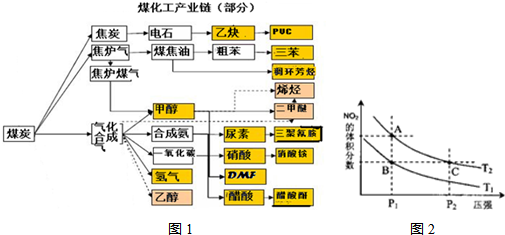
如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:(1)已知该产业链中某反应的平衡常数表达式为:K=
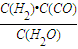 ,它所对应反应的化学方程式是 .
,它所对应反应的化学方程式是 .(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160.此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
②比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向 (填“逆向”、“正向”或“不”)移动,平衡常数K (填“增大”、“减小”或“不变”).
(3)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:N2(g)+O2(g)→2NO (g)-180.8kJ,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是 .
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大.
【答案】分析:(1)化学平衡常数指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写方程式;
(2)①根据v=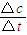 计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
②计算此时的浓度商Qc,与平衡常数相比判断反应进行方向,据此判断速率大小;
③容器的体积缩小一半,压强增大,平衡向体积减小的方向移动;平衡常数只受温度影响,温度不变,平衡常数不变;
(3)A、化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关;
B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小;
C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高;
D、化学平衡常数说明反应进行的彻底程度问题,与反应速率无关.
解答:解:(1)平衡表达式为:K= ,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g),故答案为:C(s)+H2O(g)?CO(g)+H2(g);
,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g),故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)①由表中数据可知,l0min内甲醇的浓度变化为0.4mol/L,故v(CH3OH)= =0.04mol/(L?min),速率之比等于化学计量数之比,故v(H2)=2v(CH3OH)=2×0.04mol/(L?min)=0.08mol/(L?min),故答案为:0.08mol/(L?min);
=0.04mol/(L?min),速率之比等于化学计量数之比,故v(H2)=2v(CH3OH)=2×0.04mol/(L?min)=0.08mol/(L?min),故答案为:0.08mol/(L?min);
②10min时,CO的浓度为0.1mol/L,氢气的浓度为0.2mol/L,甲醇的浓度为0.4mol/L,故此时的浓度商Qc= =100,小于平衡常数160,故反应向正反应进行,故v正>v逆,
=100,小于平衡常数160,故反应向正反应进行,故v正>v逆,
故答案为:>;
③容器的体积缩小一半,压强增大,平衡向体积减小的方向移动,故平衡向正反应移动;
平衡常数只受温度影响,与压强无关,温度不变,平衡常数不变;
故答案为:正向;不变;
(3)A、化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关,故A错误;
B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小,没有实际意义,故B正确;
C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高,反应越完全,故C正确;
D、化学平衡常数说明反应进行的彻底程度问题,与反应速率无关,故D错误;
故答案为:BC.
点评:本题考查化学平衡常数及影响因素、意义,反应速率计算等,难度中等,(1)中判断有固体碳参加反应是关键,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关.
(2)①根据v=
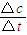 计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);②计算此时的浓度商Qc,与平衡常数相比判断反应进行方向,据此判断速率大小;
③容器的体积缩小一半,压强增大,平衡向体积减小的方向移动;平衡常数只受温度影响,温度不变,平衡常数不变;
(3)A、化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关;
B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小;
C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高;
D、化学平衡常数说明反应进行的彻底程度问题,与反应速率无关.
解答:解:(1)平衡表达式为:K=
 ,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g),故答案为:C(s)+H2O(g)?CO(g)+H2(g);
,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g),故答案为:C(s)+H2O(g)?CO(g)+H2(g);(2)①由表中数据可知,l0min内甲醇的浓度变化为0.4mol/L,故v(CH3OH)=
 =0.04mol/(L?min),速率之比等于化学计量数之比,故v(H2)=2v(CH3OH)=2×0.04mol/(L?min)=0.08mol/(L?min),故答案为:0.08mol/(L?min);
=0.04mol/(L?min),速率之比等于化学计量数之比,故v(H2)=2v(CH3OH)=2×0.04mol/(L?min)=0.08mol/(L?min),故答案为:0.08mol/(L?min);②10min时,CO的浓度为0.1mol/L,氢气的浓度为0.2mol/L,甲醇的浓度为0.4mol/L,故此时的浓度商Qc=
 =100,小于平衡常数160,故反应向正反应进行,故v正>v逆,
=100,小于平衡常数160,故反应向正反应进行,故v正>v逆,故答案为:>;
③容器的体积缩小一半,压强增大,平衡向体积减小的方向移动,故平衡向正反应移动;
平衡常数只受温度影响,与压强无关,温度不变,平衡常数不变;
故答案为:正向;不变;
(3)A、化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关,故A错误;
B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小,没有实际意义,故B正确;
C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高,反应越完全,故C正确;
D、化学平衡常数说明反应进行的彻底程度问题,与反应速率无关,故D错误;
故答案为:BC.
点评:本题考查化学平衡常数及影响因素、意义,反应速率计算等,难度中等,(1)中判断有固体碳参加反应是关键,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关.

练习册系列答案
相关题目
如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡常数表达式为: ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
_________________________________。
(2)合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
|
物质 |
H2 |
CO |
CH3OH |
|
浓度(mol/L) |
0.2 |
0.1 |
0.4 |
①该时间段内反应速率v(H2)=
②比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向 (填“逆向”、“正向”或“不”)移动,平衡常数K (填“增大”、“减小” 或“不变”)。
(3)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) →2NO (g) -180.8 kJ,工业合成氨则是人工固氮。分析两种固氮反应的平衡常数,下列结论正确的是 。
|
反应 |
大气固氮 |
工业固氮 |
||||
|
温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
|
K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
 (2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题: