题目内容
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2(s)+Pb(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(I),根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb+SO42--2e-=PbSO4↓ |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
B
解析试题分析:在铅蓄电池的反应中,PbO2是正极,被还原,Pb是负极,被 氧化,电极反应式为:Pb+SO42--2e-=PbSO4↓;电池放电时消耗硫酸,溶液的酸性减弱你,综上,B正确。
考点:铅蓄电池

用如图所示装置制取纯净的Fe(OH)2,下列说法不正确的是
| A.a电极一定是铁,电解液c可以是CuCl2溶液 |
| B.电解一段时间,b电极附近pH升高 |
| C.溶液中的阴离子向a电极移动 |
| D.在加入苯之前应将电解液c加热煮沸 |
将下图所示实验装置的K闭合,下列判断错误的是
| A.盐桥中的K+移向乙池 |
B.电子沿Zn a a b b Cu路径流动 Cu路径流动 |
| C.b电极上的反应式为4OH-—4e-=O2↑+2H2O |
| D.片刻后可观察到滤纸a点变红色 |
人工肾脏可用间接电化学方法除去代谢产物中的尿素[(CO(NH2)2) ],即通过阳极反应生成具有强氧化作用的中间产物来氧化代谢产物,原理如右图所示,下列说法正确的是
| A.B为 电 源 的正 极 |
| B.电解过程中,阳极室附近的PH保持不变 |
| C.电解过程中,电子由电源B端流出经溶液流回到电源A端 |
| D.右边发生的电极反应式为:2H2O +2e-= H2↑+ 2OH- |
下列实验装置图合理的是 

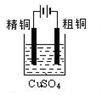

① ② ③ ④
| A.装置①可用于证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 |
| B.装置②能构成锌铜原电池 |
| C.装置③可用于粗铜的电解精炼 |
| D.装置④可用于在实验室测定中和反应的反应热 |
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和 b 附近分别滴加一滴石蕊溶液。下列实验现象中错误的是
| A.a电极附近呈红色,b电极附近呈蓝色 |
| B.a电极附近呈蓝色,b电极附近呈红色 |
| C.逸出气体的体积,a电极的大于b电极的 |
| D.a、b两电极都逸出无色无味气体 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
| A.放电时负极附近溶液的pH不变 |
| B.放电时电解质溶液中的OH-向正极移动 |
| C.充电时电池的负极应与电源的负极相连接 |
| D.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O |
某研究性学习小组用如图装置研究不同能量之间的转化问题。下列说法正确的是( )
| A.断开开关S1,闭合开关S2,化学能转化为电能,电能转化为光能等 |
| B.断开开关S1,闭合开关S2,此时构成的装置属于电解池 |
| C.断开开关S2,闭合开关S1,此时构成的装置属于原电池 |
| D.断开开关S2,闭合开关S1,化学能转化为电能 |
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用右图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体V mL。下列说法正确的是( )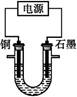
| A.铜电极连接电源正极 |
| B.黑色粉末X是铁粉 |
C.铜的相对原子质量的计算式是 |
D.石墨电极上发生的反应是4OH--4e- O2↑+2H2O O2↑+2H2O |