题目内容
25℃,101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3 kJ/mol;辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A.CH3COOH(aq)+NaOH(aq)="=="
CH3COONa(aq)+H2O(l) 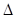 H=
H=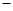 57.3kJ/mol
57.3kJ/mol
B.KOH(aq)+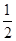 H
H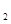 SO4(aq)=
SO4(aq)= 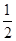 K2SO4(aq)+H2O(l)
K2SO4(aq)+H2O(l)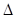 H=
H=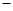 57.3kJ/mol
57.3kJ/mol
C.C8H18(l)+
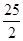 O2 (g)=8CO2 (g)+ 9H2O(g)
O2 (g)=8CO2 (g)+ 9H2O(g)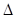 H=
H=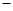 5518 kJ/mol
5518 kJ/mol
D.2C8H18(g)+25O2
(g)=16CO2 (g)+18H2O(1)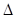 H=
H=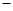 11036 kJ/mol
11036 kJ/mol
【答案】
BD
【解析】
试题分析:A.错误,因为醋酸是弱酸,发生中和反应生成1mol水时所放出的热量会小于57.3 kJ/mol。
B.属于强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3 kJ/mol。正确。
C.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量。所以应该生成液态水,故C错误。
D.正确
答案选BD 。
考点:热化学方程式的书写
点评:理解热化学方程式的书写,还要注意中和热与燃烧热的概念。燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
下列说法中正确的是( )
| A、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的△H不同 | B、常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 | C、1mol硫酸与1mol Ba(OH)2完全中和所放出的热量为中和热 | D、在25℃、101KPa时,2mol S的燃烧热是1mol S的2倍 |
 试回答:
试回答: