题目内容
下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是
| A.K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了 |
| B.比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 |
| C.K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大 |
| D.弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka ·Kh |
C
试题分析:A、相同条件下不同反应的K值越大,表示反应进行的程度越大;相同的化学反应在不同条件下,K值越大,表示反应进行的程度越大,故A正确;B、比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解,Qc>Ksp时 ,溶液过饱和有沉淀析出;Qc=Ks时,溶液饱和,沉淀与溶解处于平衡状态;Qc<Ksp时,溶液不饱和无沉淀析出,故B正确;C、平衡常数都是温度的函数,随温度变化做相应的变化,电离平衡常数、水的离子积常数和溶解平衡常数温度升高其值都增大,但是化学平衡常数随温度的变化和反应的吸放热情况有关,故C错误;水解和电离为可逆过程,Ka=
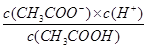 ,Kb=
,Kb=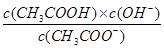 ;则有Ka?Kh=Kw,故D正确。
;则有Ka?Kh=Kw,故D正确。
练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
 2SO3(g),若开始时只充入2 molSO3,达到平衡时,混合气体的压强比起始时增大了10%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为:
2SO3(g),若开始时只充入2 molSO3,达到平衡时,混合气体的压强比起始时增大了10%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为: CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-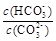 减小
减小 CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol, H2+I2平衡体系增加压强使颜色变深
H2+I2平衡体系增加压强使颜色变深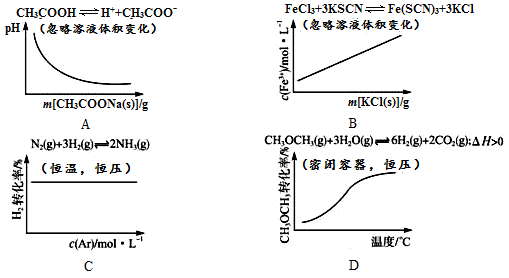
 Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是 eC(气)+fD(气),反应过程中保持其他条件不变,C的体积分
eC(气)+fD(气),反应过程中保持其他条件不变,C的体积分