题目内容
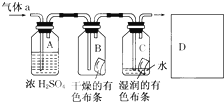 某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气.
某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
(1)实验室制备氯气的方程式是:
(2)浓硫酸的作用是
(3)D装置里盛放的是NaOH溶液,其作用是:
分析:(1)实验室利用二氧化锰和浓盐酸来制取氯气;
(2)浓硫酸具有吸水性,常用作干燥剂;干燥的氯气通入B,不能使干燥的有色布条褪色,在通入湿润的有色布条,布条褪色,证明干燥氯气不具有漂白性,次氯酸具有漂白性;
(3)氯气有毒,必须进行尾气处理,可用NaOH溶液进行尾气处理,防止其造成空气污染,氯气和氢氧化钠反应生成氯化钠、次氯酸钠、和水.
(2)浓硫酸具有吸水性,常用作干燥剂;干燥的氯气通入B,不能使干燥的有色布条褪色,在通入湿润的有色布条,布条褪色,证明干燥氯气不具有漂白性,次氯酸具有漂白性;
(3)氯气有毒,必须进行尾气处理,可用NaOH溶液进行尾气处理,防止其造成空气污染,氯气和氢氧化钠反应生成氯化钠、次氯酸钠、和水.
解答:解:(1)实验室利用二氧化锰作氧化剂和还原剂浓盐酸在加热的条件下反应,生成二氧化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)浓硫酸具有吸水性,常用作干燥剂,本试验中起到吸收气体a中的水的作用;干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,所以B、C两个装置中布条褪色的是C;氯气漂白起作用的成分是HClO,
故答案为:干燥氯气;C;HClO;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,用NaOH溶液来吸收的反应为Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式为Cl2+2OH-=Cl-+ClO-+H20,
故答案为:吸收尾气;Cl2+2OH-=Cl-+ClO-+H20.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)浓硫酸具有吸水性,常用作干燥剂,本试验中起到吸收气体a中的水的作用;干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,所以B、C两个装置中布条褪色的是C;氯气漂白起作用的成分是HClO,
故答案为:干燥氯气;C;HClO;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,用NaOH溶液来吸收的反应为Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式为Cl2+2OH-=Cl-+ClO-+H20,
故答案为:吸收尾气;Cl2+2OH-=Cl-+ClO-+H20.
点评:本题考查氯气的漂白性的探究实验,注意把握反应的原理以及实验的注意事项,题目较简单.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目


