题目内容
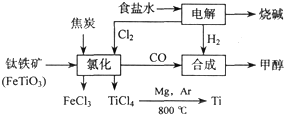
(2011?淮南二模)钛(Ti)被称为继铁、铝之后的“21世纪金属”金属,应用前景广泛.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白:
(1)电解食盐水总反应的离子方程式是
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ/mol;②Ti(s)+2Cl2(g)=TiCl4(s)△H=-770kJ/mol.
下列说法中正确的是
A.Mg的燃烧热为641kJ/mol
B.Ti的能量一定比TiCl4高
C.等质量的Mg(s)、Ti(s)足量的氯气反应,前者放出的热量多
D.该冶炼Ti法对环境友好
(4)某厂日合成甲醇8.1t,理论上需氢气
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中正极上的电极反应式是

(1)电解食盐水总反应的离子方程式是
2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
;
| ||
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式
2FeTiO3+6C+7Cl2
2TiCl4+2FeCl3+6CO
| ||
2FeTiO3+6C+7Cl2
2TiCl4+2FeCl3+6CO
;
| ||
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ/mol;②Ti(s)+2Cl2(g)=TiCl4(s)△H=-770kJ/mol.
下列说法中正确的是
C
C
;A.Mg的燃烧热为641kJ/mol
B.Ti的能量一定比TiCl4高
C.等质量的Mg(s)、Ti(s)足量的氯气反应,前者放出的热量多
D.该冶炼Ti法对环境友好
(4)某厂日合成甲醇8.1t,理论上需氢气
0.5
0.5
t (不考虑生产过程中的损失).(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中正极上的电极反应式是
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.分析:(1)电解食盐水生成NaOH、H2和Cl2,以此书写离子方程式;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式;
(3)A.根据燃烧热的定义判断;
B.反应热为反应物总能量与生成物总能量的差值;
C.根据方程式计算;
D.该冶炼过程使用了有毒Cl2,对环境有影响.
(4)根据反应的关系式计算;
(5)碱性甲醇电池中,O2在正极得电子发生还原反应.
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式;
(3)A.根据燃烧热的定义判断;
B.反应热为反应物总能量与生成物总能量的差值;
C.根据方程式计算;
D.该冶炼过程使用了有毒Cl2,对环境有影响.
(4)根据反应的关系式计算;
(5)碱性甲醇电池中,O2在正极得电子发生还原反应.
解答:解:(1)电解食盐水生成NaOH、H2和Cl2,反应的离子方程式为2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为:
2FeTiO3+6C+7Cl2
2TiCl4+2FeCl3+6CO,故答案为:2FeTiO3+6C+7Cl2
2TiCl4+2FeCl3+6CO;
(3)A.Mg不是在O2中燃烧,故641kJ/mol不能称其燃烧热,故A错误;
B.反应Ti(s)+2Cl2(g)=TiCl4(s)为放热反应,1mol Ti(s)和2mol Cl2 (g)的总能量大于1mol TiCl4 (s)的总能量,故B错误;
C.假设质量均为24g,则Mg(s)与足量Cl2(g)反应放出641kJ热量,24gTi(s) 与足量Cl2(g)反应放出的热量=
×770kJ/mol=385kJ,故C正确;
D.该冶炼过程使用了有毒Cl2,对环境有影响.故D错误.
故答案为:C;
(4)根据CO+2H2→CH3OH,CH3OH~CO~
Cl2~
H2,所以生产1 molCH3OH,理论上还需补充氢气2-
=
mol,即
gH2,故生产8.1t CH3OH还需补充H2的质量0.5t.
故答案为:0.5;
(5)碱性甲醇电池中,O2在正极得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-.
| ||
故答案为:2Cl-+2H2O
| ||
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为:
2FeTiO3+6C+7Cl2
| ||
| ||
(3)A.Mg不是在O2中燃烧,故641kJ/mol不能称其燃烧热,故A错误;
B.反应Ti(s)+2Cl2(g)=TiCl4(s)为放热反应,1mol Ti(s)和2mol Cl2 (g)的总能量大于1mol TiCl4 (s)的总能量,故B错误;
C.假设质量均为24g,则Mg(s)与足量Cl2(g)反应放出641kJ热量,24gTi(s) 与足量Cl2(g)反应放出的热量=
| 24g |
| 48g/mol |
D.该冶炼过程使用了有毒Cl2,对环境有影响.故D错误.
故答案为:C;
(4)根据CO+2H2→CH3OH,CH3OH~CO~
| 7 |
| 6 |
| 7 |
| 6 |
| 7 |
| 6 |
| 5 |
| 6 |
| 5 |
| 3 |
故答案为:0.5;
(5)碱性甲醇电池中,O2在正极得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-.
点评:本题考查较为综合,涉及离子方程式、化学反应与能量、电化学等知识,题目难度中等,本题注意把握电极方程式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
