题目内容
(10分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A. HCN B. HClO C. CH3COOH D. H2CO3
(2)实验室中常用NaOH来进行洗气和提纯。
①当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________ ______ 。
②几种离子开始沉淀时的pH如下表:
|
离子 |
Fe2+ |
Cu2+ |
Mg2+ |
|
pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,_______(填离子符号)先沉淀,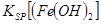 _________
_________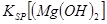 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
1)CO32- (2分) C (2分)
(2)①
② Cu2+ (2分) < (2分)
【解析】
试题分析:(1)五种钠盐都属于强碱弱酸盐,越弱越水解,且水解后的溶液碱性越强,水解程度越大,故Na2CO3水解程度最大,即CO32-结合H+能力最强。由表知道,CH3COOH最弱,故越弱越电离,稀释后,最弱的pH变化最大。
(2)①0.3mol的NaOH溶液吸收标准状况下4.48LCO2时,CO2过量,故生成物为NaHCO3,在溶液中,存在着HCO3-的电离和水解反应,且水解大于电离
考点:弱电解质的电离和水解。
点评:此题考核了弱电解质的电离和水解,要记得弱酸根或弱碱根是越弱越水解,弱酸盐和弱碱盐是越弱越电离。

(10分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A. HCN B. HClO C. CH3COOH D. H2CO3
(2)实验室中常用NaOH来进行洗气和提纯。
①当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________ ______ 。
②几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
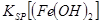 _________
_________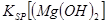 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。  (2013?德州模拟)钠及其化合物具有广泛的用途.
(2013?德州模拟)钠及其化合物具有广泛的用途.
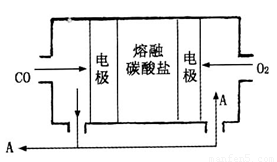
 (1)工业上可利用反应Na(1)+ KCl(1)
K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___
_____,
(1)工业上可利用反应Na(1)+ KCl(1)
K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___
_____,