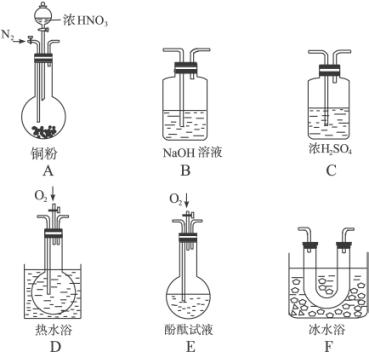
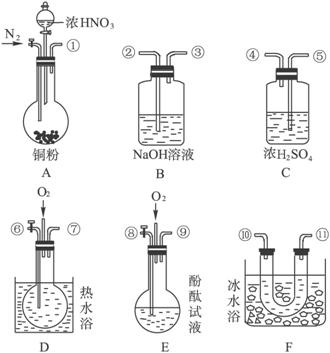
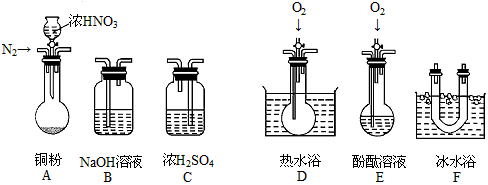
题目内容
甲、乙、丙三个实验小组分别进行测定Na2CO3和NaOH混合物中Na2CO3含量的实验。
(1)甲组:沉淀分析法
把m g混合物溶解后假如过量BaCl2,然后将所得沉淀过滤、洗涤、烘干、称量,固体质量为w g,根据沉淀质量计算原混合物中Na2CO3质量分数为 。写出反应的离子方程式 。如果原溶液中过量的Ba2+浓度达到0.01mol/L,则溶液中残留的CO32-的质量的量浓度是 。(Ksp(BaCO3)=2.58×10-9)
(2)乙组:气体分析法
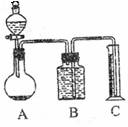
把m g混合物与过量盐酸反应后,用如上图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是 ,选用该溶液后实验结果还是不准确,原因是 。针对上述问题,乙组同学改用测定反应结束后容器A中溶质质量的方法测定Na2CO3和NaOH混合物中Na2CO3含量,如果在加热蒸发的过程中操作不当引起固体飞溅,则测出的样品中Na2CO3的质量分数将 。(填“偏大”或“偏小”)
(3)丙组:滴定分析法
称量m g混合物试样于锥形瓶中,加水使之溶解后,加酚酞指示液2滴,用c mol/LHCl标准滴定溶液至溶液由红色恰好变为无色(Na2CO3+HCl===NaHCO3+NaCl),消耗HCl 溶液V1mL,然后,加入甲基橙指示液1~2滴,继续用HCl标准滴定溶液滴定至溶液由黄色变为橙色(NaHCO3+HCl==NaCl+CO2↑+H2O),消耗HCl溶液V2mL。则样品中Na2CO3的质量分数为 。
(1)![]() ,Ba2+CO32-=BaCO3↓,2.58×10-7mol/L
,Ba2+CO32-=BaCO3↓,2.58×10-7mol/L
(2)饱和NaHCO3,CO2带出HCl与NaHCO3反应生成CO2
HCl+NaHCO3=NaCl+H2O+CO2↑ 偏小
(3)![]()

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案