��Ŀ����
��1����Ԫ���ж��ֻ��ϼۣ����γɶ��ֻ������д�±��еĿհף�
|
���ϼ� |
-2 |
-1 |
0 |
+2 |
+4 |
+6 |
+7 |
|
������Ļ�ѧʽ |
|
FeS2 |
S |
Na2S2O3 |
|
SO3��H2SO4��Na2SO4 |
Na2S2O8 |
��2����֪NaHSO3��Һ������ݣ���д������Һ�д��ڵĸ���ƽ�ⷴӦ�����ӷ���ʽ�� ��
��3���밴��Ũ���ɴ�С��˳������Na2SO3��Һ�е����ӣ� ��
Na2SO3��Һ�����ڿ�����һ��ʱ�����Һ��pH (�������С�����䡱)��(������ˮ������)ԭ����
��
��4��ijͬѧ�������ʵ������̽��Na2S2O3�Ļ�ѧ���ʡ�
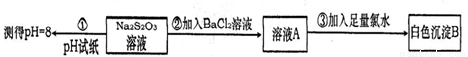
ʵ��ٿ�˵��Na2S2O3�ܷ���ˮ�⣬ʵ��ڢ�˵��Na2S2O3���� �ԡ�����Ԥ��Na2S2O3�����ܾ��еĻ�ѧ����(�о�2������) �� ��
��1����2�֣�
|
���ϼ� |
-2 |
-1 |
0 |
+2 |
+4 |
+6 |
+7 |
|
������Ļ�ѧʽ |
Na2S��H2S�� |
|
|
|
SO2��Na2SO3 |
|
|
��2��HSO3�� H��+SO32����HSO3��+H2O
H��+SO32����HSO3��+H2O H2SO3+OH����H2O
H2SO3+OH����H2O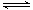 H��+OH������3�֣�ÿ������ʽ1�֣�
H��+OH������3�֣�ÿ������ʽ1�֣�
��3��c��Na������c��SO32������c��OH������c��HSO3������c��H������2�֣�����С��1�֣���2SO32����O2=2SO42����SO32������������SO42����SO32����Ũ�ȼ�С��ˮ�������OH��Ũ�ȼ�С����ҺpH��С����2�֣�ֻҪ������������д����ʽҲ�÷֣�
��4����ԭ�����������ԡ������ԣ������������ӽ�ϲ���������������ԣ������γ��������ܷ����绯��Ӧ����Ⱦ����������־��л�ԭ�ԣ��������һ��1�֣���3�֣����÷֣�ֻҪ�������ɵ÷֣�
��������
�����������1����Ԫ�ر���-2�ۣ������Ƶȣ���Ԫ�ر���+4�ۣ��ж��������������εȣ��ʴ�Ϊ��Na2S�ȣ�SO2�ȣ�
��2����Һ�д���ˮ�ĵ���ƽ�⡢����������ĵ���ƽ����ˮ��ƽ�⣬ƽ�ⷴӦ�����ӷ���ʽ�ֱ�ΪHSO3��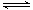 H��+SO32����HSO3��+H2O
H��+SO32����HSO3��+H2O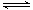 H2SO3+OH����H2O
H2SO3+OH����H2O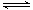 H��+OH����
H��+OH����
��3��Na2SO3��Һ�������ˮ��õ��������������Һ�ʼ��ԣ�����������ˮ��õ������ᣬͬʱ����ˮ�ĵ��룬����Һ�����������ӵ�Ũ�ȴ���������������ӣ����������£�������Ũ��ԭС���������������Ũ�ȣ�ˮ��̶Ȳ����������Ũ�ȴ�������������Ũ�ȣ�����Һ������Ũ�ȴ�С��ϵΪ��c��Na������c��SO32������c��OH������c��HSO3������c��H������
Na2SO3��Һ�����ڿ�����һ��ʱ���SO32������������SO42����SO32����Ũ�ȼ�С��ˮ�������OH��Ũ�ȼ�С����ҺpH��С��
��4��Na2S2O3��Һ���Ȼ�����Һ��Ϻ�û��������������ˮ���а�ɫ�������ɣ��ó���Ϊ���ᱵ����Ӧ����Ԫ�صĻ��ϼ����ߣ�Na2S2O3���ֻ�ԭ�ԣ�
Na2S2O3����Ԫ�صĻ��ϼ۴����м��̬�����������ԡ���ԭ�ԣ����ܷ����绯��Ӧ�ȣ�
���㣺���⿼����Ԫ�ػ���������ʡ����û�ѧ�������ˮ�⡢����Ũ�ȱȽϵȡ�

����ֵ�����ܶ࣬����һ����Ԫ�����⣬�����н϶��Cr(������Ni(������Mo(�⣩������ ��Si(�裩��C(̼��������S(��P(�ף���
��1������Ԫ�������ڵ��������ҵ�һ�����ܴӴ�С���е���_______
��2��Mo���⣩���ڵ������ڣ�����Cr������Ԫ��λ��ͬһ�壬���̬Mo���⣩ԭ�ӵ���Χ���ӣ��۵��ӣ��Ų�ʽ��_______��
��3��CH4�ķе��SiH4�ͣ�ԭ����_______��
��4����Ԫ�����γɶ�������������[Ni(CN)4]2���в����е���____����ѡ���ţ���
A�����Ӽ� B����λ�� C���Ҽ� D���м� E�����
��5��̼Ԫ���ж��ֵ��ʣ�����C60�����ж��ص����νṹ��C60������ԭ�ӹ���ӻ�������_______��

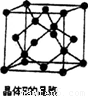
��6��̼����һ�ֵ���ʯī�ʲ�״�ṹ����һ̼þ���Ͳ��Ͼ�����ʯī̼ԭ�Ӳ�����þԭ�Ӳ㣬���㸩��ͼ��

�ò��ϵĻ�ѧʽΪ_______��
 ���ݷ�ˮ�������к����ʵIJ�ͬ����ҵ���ж��ַ�ˮ�Ĵ���������
���ݷ�ˮ�������к����ʵIJ�ͬ����ҵ���ж��ַ�ˮ�Ĵ���������