题目内容
(8分)有一瓶澄清溶液,可能含有 、
、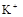 、
、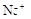 、
、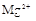 、
、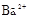 、
、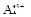 、、
、、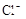 、
、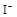 、
、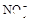 、
、 、
、 中的一种或几种。取该溶液进行以下实验:
中的一种或几种。取该溶液进行以下实验:
①用pH试纸检验,表明溶液呈强酸性;
②取出部分溶液,加入少量 及数滴新制氯水,经振荡
及数滴新制氯水,经振荡 层呈紫红色;
层呈紫红色;
③另取部分溶液,向其中逐滴加入NaOH溶液,使溶液从酸性变为碱性,在滴加过程中先生成白色沉淀后完全溶解;取部分碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝。
④另取部分③中的碱性溶液,向其中加入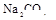 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
根据以上实验事实回答下列问题:
(1)该溶液中肯定存在的离子是 ,肯定不存在的离子是 ;
(2)步骤③加入NaOH溶液过程中先生成白色沉淀后完全溶解的离子方程式为 ;
(1)Ba2+、Al3+、I-、NH4+;Mg2+、Fe3+、CO23-、SO24-、NO-3 (每空2分,共4分)
(2)Al3+++3OH-=Al(OH)3↓ Al(OH)3+OH-=[Al(OH)4]- (每空2分,共4分)
解析试题分析:(1)①中由于溶液显酸性,所以碳酸根离子不存在;②中证明有I-,而溶液呈强酸性,则不存在NO3-。③中沉淀溶解,证明有Al3+,NH4+,肯定没有的是Fe3+,④证明有Ba2+,则不存在SO42-。(2)第一步沉淀是氢氧化铝沉淀,第二步是氢氧化铝沉淀与氢氧化钠反应溶解。
考点:离子反应,氢氧化铝的性质
点评:本题涉及到了很多离子的检验和离子之间的反应,学生应熟悉常见离子之间的反应和离子检验的方法。

 口算能手系列答案
口算能手系列答案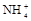 、
、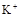 、
、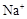 、
、 、
、 、
、 、
、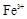 、
、 、
、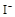 、
、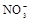 、
、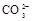 、
、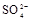 中的一种或几种。取该溶液进行以下实验:
中的一种或几种。取该溶液进行以下实验: 及数滴新制氯水,经振荡
及数滴新制氯水,经振荡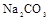 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。 、
、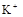 、
、 、
、 、
、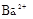 、
、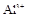 、、
、、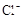 、
、 、
、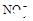 、
、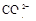 、
、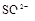 中的一种或几种。取该溶液进行以下实验:
中的一种或几种。取该溶液进行以下实验: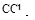 及数滴新制氯水,经振荡
及数滴新制氯水,经振荡 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。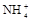 、
、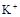 、
、 、
、 、
、 、
、 、
、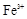 、
、 、
、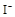 、
、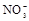 、
、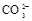 、
、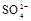 中的一种或几种。取该溶液进行以下实验:
中的一种或几种。取该溶液进行以下实验: 及数滴新制氯水,经振荡
及数滴新制氯水,经振荡 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。