题目内容
常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L-1 AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12 L时,假设溶液体积不变,下列说法正确的是
A.阴极增重1.72 g B.所得溶液 pH<1
C.阴极增重0.64 g D.所得溶液pH>1
AB
【解析】溶液中铜离子和银离子的物质的量都是0.01mol,根据放电顺序可知,阴极首先是银离子放电,生成银,然后是铜离子放电生成铜。阳极是OH-放电生成氧气,即氧气是0.05mol,转移电子是0.2mol,所以根据电子的得失守恒可知,阴极除了生成0.01mol银和铜外,还生成0.085mol氢气,所以阴极增加的质量是1.08g+0.64g=1.72g,A正确;在金属离子放电的同时,溶液中产生氢离子,所以B也正确,答案选AB。

 津桥教育计算小状元系列答案
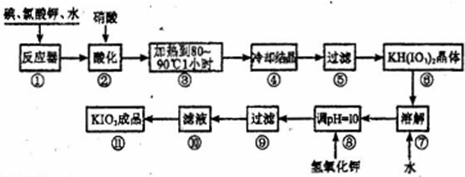
津桥教育计算小状元系列答案碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式: _______________。
若有1 mol I2完全反应,则该反应中转移电子的数目为______(设NA表示阿伏加德罗常数)
(2)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________。
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是__________。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
(5)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阳极的电极反应式为:___________________________。

 得到碘酸钾晶体,你建议的方法是
得到碘酸钾晶体,你建议的方法是