题目内容
下列有关晶体的叙述中错误的是
| A.离子晶体中一定存在离子键 | B.原子晶体中,只存在共价键 |
| C.金属晶体的熔沸点均很高 | D.稀有气体的原子能形成分子晶体 |
C
解析试题分析:离子晶体,是指离子间通过离子键结合形成的晶体,故A正确;原子晶体,是指相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体,故B正确;金属晶体是由金属元素构成的晶体,其熔沸点有的很高,如钨、铂等,有的则很低,如汞、镓等,故C错误;稀有气体的单质都是单原子分子,它们不能形成化学键,只能以微弱的分子间作用力结合,故形成分子晶体,D正确。
考点:晶体结构与性质
点评:晶体结构与性质在高考中考查难度并不大,考生在备考中主要掌握各类晶体的概念及其主要性质。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
下列有关晶体的叙述中,错误的是( )
| A、在SiO2晶体中,每个Si原子与4个O原子形成共价键 | B、在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子 | C、NaCl晶体中与每个Na+距离相等且最近的Cl-有6个 | D、CsCl晶体中与每个Cs+距离相等且最近的Cl-有8个 |
(1)下列有关晶体的叙述中错误的是
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图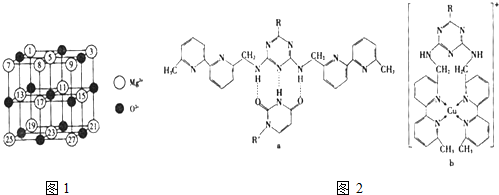
中错误: .(用文字表述)
(3)第三周期部分元素氟化物的熔点见下表:
解释表中氟化物熔点差异的原因: .
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合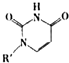 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含 ,b中含 .(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图

中错误:
(3)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含