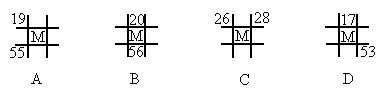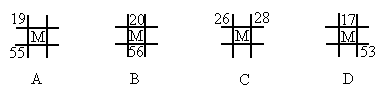题目内容
如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:(1)B、D形成的化合物甲,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为______;乙的化学式为______.
(2)B、D分别可与E形成化合物丙、丁,丙属于______ (填“非极性”或“极性”)分子,试将甲、乙、丙、丁四种物质按熔点由高到低的顺序排列:______.(用化学式表示)
(3)B和C元素形成的物质(BC)2可称为拟卤素,写出该物质与NaOH溶液反应的离子方程式______.
(4)C、E形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体、C的最高价含氧酸及E的氢化物,写出该反应的化学方程式______.
【答案】分析:A、B、C、D、E均为短周期主族元素,由各元素的相对位置可知,B、C处于第二周期,A、D、E处于第三周期,B元素原子的最外层有4个电子,则B为碳元素,故C为氮元素;B、D同主族,故D为硅元素;E原子最外层电子数与C的原子序数相等,则E最外层电子数为7,故E为氯元素.
(1)甲、乙,晶体结构均为空间网状结构,晶体类型为原子晶体;乙的化学式为Si3N4.
(2)原子晶体沸点高于分子晶体,甲(SiC)、乙(Si3N4)是原子晶体,键长C-Si键比N-Si键长,N-Si键更稳定,Si3N4沸点高,丙(CCl4)、丁(SiCl4)都是分子晶体,结构相似,相对分子质量越大,沸点越高.
(3)根据氯气与水反应生成HClO和HCl书写.
(4)NCl3在潮湿的空气中与水蒸气能发生氧化还原反应,生成NO、HNO3、HCl.
解答:解:A、B、C、D、E均为短周期主族元素,由各元素的相对位置可知,B、C处于第二周期,A、D、E处于第三周期,B元素原子的最外层有4个电子,则B为碳元素,故C为氮元素;B、D同主族,故D为硅元素;E原子最外层电子数与C的原子序数相等,则E最外层电子数为7,故E为氯元素.
故B为碳元素,C为氮元素,D为硅元素,E为氯元素.
(1)B为碳元素、C为氮元素、D为硅元素,B、D形成的化合物甲为SiC,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为原子晶体;乙的化学式为Si3N4.
故答案为:原子晶体;Si3N4.
(2)B为碳元素、D为硅元素、E为氯元素.B、D分别与E形成化合物丙为CCl4、丁为SiCl4,CCl4是正四面体结构,反应非极性分子;甲(SiC)、乙(Si3N4)是原子晶体,键长C-Si键比N-Si键长,N-Si键更稳定,所以沸点乙>甲,丙(CCl4)、丁(SiCl4)都是分子晶体,结构相似,相对分子质量越大,分子间作用力越强,沸点越高,沸点丁>丙,原子晶体沸点高于分子晶体,所以沸点Si3N4>SiC>SiCl4>CCl4.
故答案为:非极性;Si3N4>SiC>SiCl4>CCl4.
(3)B为碳元素、C为氮元素,B和C元素形成的物质(CN)2为拟卤素,性质与氯气类似,(CN)2与NaOH溶液反应的离子方程式为(CN)2+2OH-=CN-+CNO-+H2O.
故答案为:(CN)2+2OH-=CN-+CNO-+H2O.
(4)C为氮元素、E为氯元素,二者形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质为NCl3,NCl3在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体为NO、C的最高价含氧酸为HNO3,E的氢化物为HCl,该反应的化学方程式为3NCl3+5H2O=2NO+HNO3+9HCl.
故答案为:3NCl3+5H2O=2NO+HNO3+9HCl.
点评:考查结构与物质关系、元素周期表、元素周期律、化学用语等,难度中等,正确推断元素的种类为解答该题的关键,注意基础知识的掌握.
(1)甲、乙,晶体结构均为空间网状结构,晶体类型为原子晶体;乙的化学式为Si3N4.
(2)原子晶体沸点高于分子晶体,甲(SiC)、乙(Si3N4)是原子晶体,键长C-Si键比N-Si键长,N-Si键更稳定,Si3N4沸点高,丙(CCl4)、丁(SiCl4)都是分子晶体,结构相似,相对分子质量越大,沸点越高.
(3)根据氯气与水反应生成HClO和HCl书写.
(4)NCl3在潮湿的空气中与水蒸气能发生氧化还原反应,生成NO、HNO3、HCl.
解答:解:A、B、C、D、E均为短周期主族元素,由各元素的相对位置可知,B、C处于第二周期,A、D、E处于第三周期,B元素原子的最外层有4个电子,则B为碳元素,故C为氮元素;B、D同主族,故D为硅元素;E原子最外层电子数与C的原子序数相等,则E最外层电子数为7,故E为氯元素.
故B为碳元素,C为氮元素,D为硅元素,E为氯元素.
(1)B为碳元素、C为氮元素、D为硅元素,B、D形成的化合物甲为SiC,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为原子晶体;乙的化学式为Si3N4.
故答案为:原子晶体;Si3N4.
(2)B为碳元素、D为硅元素、E为氯元素.B、D分别与E形成化合物丙为CCl4、丁为SiCl4,CCl4是正四面体结构,反应非极性分子;甲(SiC)、乙(Si3N4)是原子晶体,键长C-Si键比N-Si键长,N-Si键更稳定,所以沸点乙>甲,丙(CCl4)、丁(SiCl4)都是分子晶体,结构相似,相对分子质量越大,分子间作用力越强,沸点越高,沸点丁>丙,原子晶体沸点高于分子晶体,所以沸点Si3N4>SiC>SiCl4>CCl4.
故答案为:非极性;Si3N4>SiC>SiCl4>CCl4.
(3)B为碳元素、C为氮元素,B和C元素形成的物质(CN)2为拟卤素,性质与氯气类似,(CN)2与NaOH溶液反应的离子方程式为(CN)2+2OH-=CN-+CNO-+H2O.
故答案为:(CN)2+2OH-=CN-+CNO-+H2O.
(4)C为氮元素、E为氯元素,二者形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质为NCl3,NCl3在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体为NO、C的最高价含氧酸为HNO3,E的氢化物为HCl,该反应的化学方程式为3NCl3+5H2O=2NO+HNO3+9HCl.
故答案为:3NCl3+5H2O=2NO+HNO3+9HCl.
点评:考查结构与物质关系、元素周期表、元素周期律、化学用语等,难度中等,正确推断元素的种类为解答该题的关键,注意基础知识的掌握.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
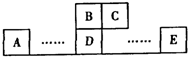 如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:
如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题: