题目内容
为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
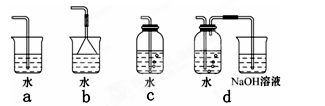
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A、B、C所示。
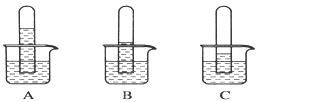
(1)在相同条件下,三种气体在水中溶解度最大的是________(写化学式)写出A烧杯中发生反应的化学方程式:____ 。如果在三只烧杯中分别滴几滴紫色石蕊试液,可观察到的现象是_____________________ 。
实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图D、E、F所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
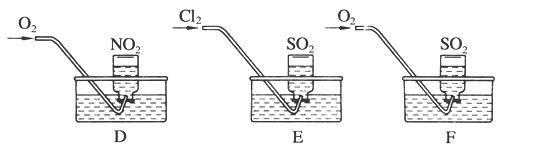
(2)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:
_______________________________________________。
②假设该实验条件下,气体摩尔体积为a L·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________________。
(3) 写出实验F通入氧气后,发生反应的化学方程式:____________________________。
(4)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,可能观察到的现象为________,用有关的离子方程式解释原因:________________________。
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A、B、C所示。

(1)在相同条件下,三种气体在水中溶解度最大的是________(写化学式)写出A烧杯中发生反应的化学方程式:____ 。如果在三只烧杯中分别滴几滴紫色石蕊试液,可观察到的现象是_____________________ 。
实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图D、E、F所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。

(2)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:
_______________________________________________。
②假设该实验条件下,气体摩尔体积为a L·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________________。
(3) 写出实验F通入氧气后,发生反应的化学方程式:____________________________。
(4)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,可能观察到的现象为________,用有关的离子方程式解释原因:________________________。
(1)NO2
3NO2+H2O=2HNO3+NO 溶液都变红色
(2)①4NO2+O2+2H2O=4HNO3 ②1/a mol·L-1
(3) 2SO2+O2+2H2O=2H2SO4
(4)出现白色沉淀 Cl2+SO2+2H2O=2Cl-+SO+4H+ Ba2++SO=BaSO4↓
3NO2+H2O=2HNO3+NO 溶液都变红色
(2)①4NO2+O2+2H2O=4HNO3 ②1/a mol·L-1
(3) 2SO2+O2+2H2O=2H2SO4
(4)出现白色沉淀 Cl2+SO2+2H2O=2Cl-+SO+4H+ Ba2++SO=BaSO4↓
试题分析:(1)NO2在水中的溶解度最大;A试管剩余气体的体积为试管体积的1/3,所以A中气体为NO2,NO2与H2O反应的方程式为:3NO2+H2O=2HNO3+NO;SO2与H2O反应生成H2SO3,NO2与H2O反应生成HNO3,CO2与水反应生成H2CO3,都显酸性,滴入石蕊试液变红。
(2)①由3NO2+H2O=2HNO3+NO和2NO+O2=2NO2,可推出总反应化学方程式为:4NO2+O2+2H2O=4HNO3
②设集气瓶的体积为VL,则充满的NO2也为VL,HNO3的浓度为:VL÷aL/mol÷VL=1/a mol·L-1。
(3)O2氧化SO2,化学方程式为: 2SO2+O2+2H2O=2H2SO4
(4)Cl2在H2O存在的条件下把SO2氧化,生成SO42?,SO42?与Ba2+反应生成BaSO4沉淀,试液现象为:出现白色沉淀;反应的离子方程式为:Cl2+SO2+2H2O=2Cl-+SO+4H+ Ba2++SO=BaSO4↓。

练习册系列答案
相关题目



 。
。