题目内容
在一密闭容器中进行以下可逆反应: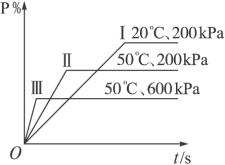
M(g)+N(g)![]() P(g)+2L
P(g)+2L
在不同的条件下P的百分含量P%的变化情况如图,则该反应( )
A.正反应放热,L是固体
B.正反应放热,L是气体
C.正反应吸热,L是气体
D.正反应放热,L是固体或气体
B
解析:图象横轴为时间,纵轴为P的百分含量,所以图中曲线的斜率表示反应速率的不同,斜率越大,反应速率越快。曲线Ⅰ表示的反应速率最小,到达平衡所需时间最长;曲线Ⅲ表示的反应速率最大,到达平衡的时间最短,三条曲线水平部分的高低不同,则表示达到平衡状态时生成物P的百分含量的高低。
联系反应物的条件再看三条曲线,Ⅰ和Ⅱ压强相同,但Ⅱ的温度较高,所以反应速率Ⅱ>Ⅰ,但达平衡时P%却是Ⅰ>Ⅱ,这说明升高温度时P%减小,因而平衡应向逆反应方向移动,则该反应的正反应为放热反应;比较曲线Ⅱ和Ⅲ,二者温度相同,但压强Ⅲ>Ⅱ,这时P%却是Ⅱ>Ⅲ,这说明增大压强时,P%降低,因此生成物中气体的总体积应大于反应物中气体的总体积,由此判断L一定为气体。

练习册系列答案
相关题目
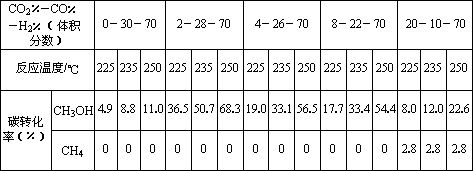
 2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。
2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。

 R(g) + 2L(?) ,此反应规律符合下图图像。
R(g) + 2L(?) ,此反应规律符合下图图像。
 2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
 2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。
2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。

 CH3OH(g) △H=
CH3OH(g) △H=