题目内容
关于下列各图的叙述,正确的是( )
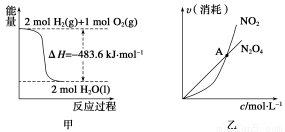
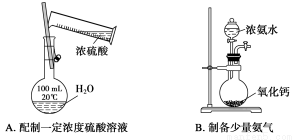
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
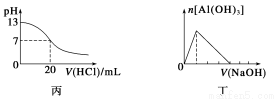
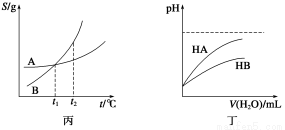
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1 ℃升温至t2 ℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
D
【解析】A项,483.6 kJ·mol-1是生成2 mol液态水对应的热量,错误;B项,交叉点A之后,速率和浓度仍在发生变化,不是平衡点,错误;C项,将A、B饱和溶液分别由t1 ℃升温至t2 ℃,由于在t1 ℃时质量分数相等,所以在t2℃时仍保持不变,溶质的质量分数B=A;D项,根据稀释时pH值的变化情况,HB的酸性小于HA的酸性,所以B-的水解程度大于A-的水解程度,同浓度时NaB的pH值大,正确。

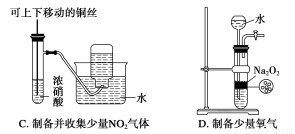
下列实验操作正确且能达到预期目的的是( )
| 实验目的 | 操作 |
① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
⑤ | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
A.①④⑤ B.②③⑤ C.①⑤⑥ D.①②③④⑤⑥
一定温度下,在2 L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
时间(s) | 0 | 500 | 1000 | 1500 |
t1℃ | 20 | 13.96 | 10.08 | 10.08 |
t2℃ | 20 | a | b | c |
下列说法一定正确的是( )
A.正反应为吸热反应
B.如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1 000 s至1 500 s之间
D.如果t2℃>t1℃,那么b>10.08